幹細胞开天闢地時刻
中美至今未批准任何一款幹細胞藥物。
幹細胞高端局在國內風起雲湧,療程一次標價7.8萬元至20萬元,2022年7月,有人在江西九江被騙450余萬元。幹細胞在醫學界被稱爲萬用細胞,被套利群體演繹成包治百病、返老還童的神藥。只有當合規產品正常供給之後,這一領域才有可能河清海晏。
幹細胞合規市場明年初迎來开天闢地時刻。Mesoblast於2024年7月向FDA重新提交remestemcel-L上市申請,PDUFA日期爲2025年1月7日,有望成爲美國首個獲批的幹細胞創新藥。2024 年6月,鉑生卓越生物的艾米邁托賽注射液成爲國內首款獲得國家藥監局新藥上市申請正式受理並納入優先審評的幹細胞新藥。
成藥性解決後,巨大的臨牀需求將在合規產品上集中釋放。
從2018年到2024年7月,國內幹細胞新藥 IND獲批83個,進入臨牀60個。據醫藥魔方數據不完全統計,國內幹細胞創新藥處於III期臨牀試驗4項,II期臨牀試驗11項。
等待一支穿雲箭。
01
黎明降至
幹細胞是人體中具有自我更新能力、多功能性和再分化能力的細胞,具有分化成各種組織和器官的潛能。作爲重要的再生醫學產品,幹細胞進入人體,哪裏有損傷、老化、病變,就在哪裏聚集,可能應用到幾乎涉及人體所有重要組織器官的修復及研究,攻克人類諸多醫學醫美難題,根治糖尿病、帕金森綜合徵、阿爾茲海默症,抗衰除皺,疤痕修復。
可見幹細胞療法是一種烏托邦藥物,戳中富裕老人的每一個痛點,具有濃鬱的老錢風,一度成爲高端定制坑。
幹細胞療法面臨着倫理和成藥挑战。胚胎幹細胞(ESC)效果最佳,卻需要破壞人類胚胎,存在倫理爭議。誘導性多能幹細胞(iPSC)的發現克服這一擔憂,卻面臨着另一場倫理爭議,其無限的分化能力有朝一日可能應用於人類克隆,並且在臨牀治療中仍具有高風險,這些細胞經移植可能會誘導腫瘤形成。雖然間充質幹細胞被普遍認爲是安全的,在當前臨牀應用中最多,從組織中分離獲得並在體外培養和擴增,具有增殖能力強、分化潛力廣泛的優點,但其持續監測和長期隨訪將是未來研究重點,需觀察、避免治療後形成腫瘤。間充質幹細胞規模化生產需要突破,供體單次取材難以滿足大規模商業化生產需求,而不同供體來源的細胞存在生物特性差異,只有保證細胞批次間產量和質量的穩定性才有可能提高制劑生產效率,獲得可重復的臨牀療效。
緩慢的進步始終在發生,FDA也快要動心。Mesoblast今年以來股價已上漲353%。
今年7月23日,FDA接受Mesoblast公司細胞療法remestemcel-L的生物制品許可申請重新提交,用於治療類固醇難治性急性移植物抗宿主病(SR-aGVHD)兒童,如果獲得批准,將成爲美國首個同種異體現貨型細胞療法,早於通用CAR-T取得突破。
remestemcel-L是一種同種異基因間充質幹細胞療法,其細胞來源於無關供體的骨髓,通過抑制T細胞增殖,和下調促炎細胞因子和幹擾素的產生,來調節T細胞介導的炎症反應。此前已公开的一項III期試驗結果顯示,患者接受治療後第28天的客觀緩解率(ORR)爲69%,與45%歷史控制率相比,有統計學意義的顯著增加。在接受至少一次輸注治療且隨訪100天的患者中,患者的死亡率爲22%,而接受初始類固醇治療無效的患者第100天死亡率高達70%。
即使Mesoblast遇挫,後面還有大將福泰制藥爲幹細胞療法托底。
一名叫Amanda Smith的35歲護士患有1型糖尿病,一直依賴胰島素維持生命。直到2023年情人節,她接受一項开創性幹細胞療法。醫生將實驗室中從胚胎幹細胞中培養出來的替代胰島細胞移植到爲Amanda Smith的肝髒供血的血管中。到8月,她不再需要胰島素了,新細胞正在大量生產胰島素。
Amanda Smith接受的幹細胞療法,是福泰制藥的VX-880,正向關鍵臨牀階段邁進。
VX-880是一種研究性同種異體幹細胞衍生、完全分化、產生胰島素的胰島細胞療法,其Ⅰ/Ⅱ期臨牀試驗數據顯示,所有接受全劑量單次輸注的12名患者在第90天時均展現出胰島細胞移植成功及對葡萄糖有反應的胰島素生成,均達到HbA1c水平低於7.0%的目標水平。並有超過70%的時間血糖值處於正常範圍(70-180 mg/dL),其中11位患者減少外源性胰島素使用或完全停用。
VX-880臨牀試驗中2名患者死亡,後經獨立監督委員會審查數據並確定死亡與試驗治療無關,臨牀試驗恢復。福泰制藥還有VX-880的升級版,將與VX880相同的同種異體幹細胞衍生的胰島細胞封裝在類似於“海蜇”的裝置中,大小約爲一枚硬幣,可通過手術植入患者體內,且無需使用免疫抑制療法。
現在輪到中國藥企上場了。
2024年5月30日,北京市藥監局核發全國第一張幹細胞《藥品生產許可證》,獲得者正是鉑生卓越,引起轟動,預示着合規幹細胞藥物即將進入產業化階段。
6月,鉑生卓越自主研發的艾米邁托賽注射液(人臍帶間充質幹細胞)上市申請獲得受理,適應症爲激素失敗的急性移植物抗宿主病(aGVHD),有望成爲全國首款幹細胞新藥。
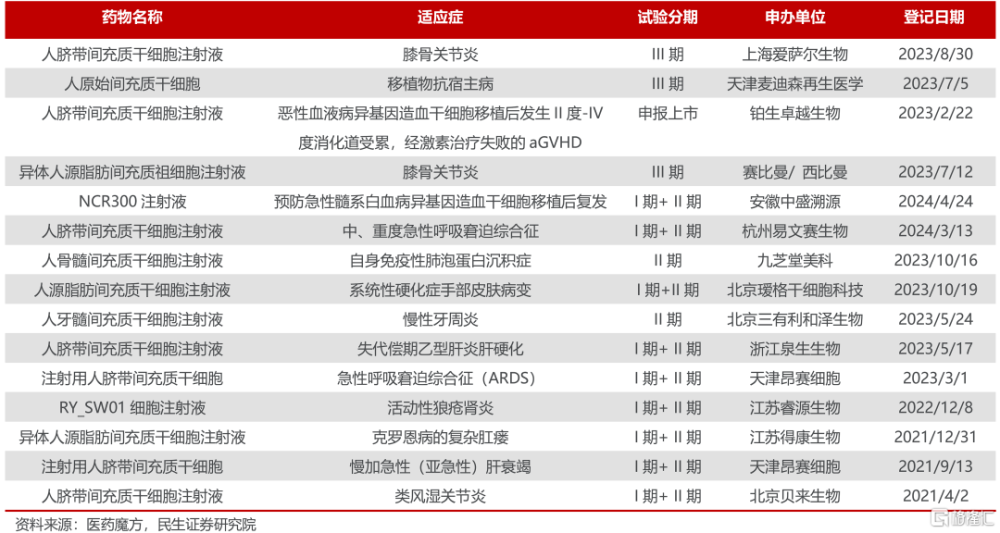 國內臨牀II期後幹細胞創新藥研發情況(不完全統計)
國內臨牀II期後幹細胞創新藥研發情況(不完全統計)
02
群起撞线
在鉑生卓越身後,還有3款幹細胞創新藥也即將撞线,分別來自愛薩爾生物(膝骨關節炎,III期)、麥迪森再生醫學(移植物抗宿主病,III期)、賽比曼/ 西比曼(膝骨關節炎,III期),行業漸呈洶湧澎湃之勢。
中源協和布局幹細胞全產業鏈,參股公司牙髓幹細胞藥物有望成爲大單品。
公司主導或參與的11個幹細胞臨牀研究項目完成備案,全資子公司武漢光谷藥業核心產品VUM02共开發8個適應症,爲自研的冷凍保存型細胞制劑,是由經篩選的健康新生兒臍帶組織通過體外分離、擴增、收獲、凍存後制備的人臍帶源間充質幹/基質細胞(UC-MSC)新藥,其中用於治療特發性肺纖維化(IPF)2023年8月獲得FDA授予的孤兒藥資格認定。
參股的北京三有利和澤生物與首都醫科大學共同申報的人牙髓間充質幹細胞注射液治療慢性牙周炎是國內首個獲得IND 受理的幹細胞新藥,於2023年5月進入II期臨牀試驗,目前已有受試者入組給藥。
傳統牙周炎治療聚焦炎症控制,阻止或延緩疾病進程,難以獲得滿意的牙周組織再生,目前臨牀常用的植骨術依賴手術方式實施。國內外尚無與“人牙髓間充質幹細胞注射液”局部注射治療類似的非侵入式的牙周組織再生引導技術。
牙周炎發病率高,危害大,是導致成年人牙齒缺失的最主要原因。據民生證券測算,2023年我國中重度牙周炎患者約10087萬人,三有利牙髓幹細胞預計2027年獲批上市銷售,至少在2031年前享有市場獨佔期,2033年銷售額有望達到約77億元。
天士力引進的remestemcel-L暫停研究,是悲是喜?
2018 年7月,天士力與前文所述幹細胞明星Mesoblast籤署MPC-150-IM(rexlemestrocel-L)產品开發商業化協議。2023 年1月,公司公告決定暫停rexlemestrocel-L研究工作,主要是在美國審評審批遇到波折,是否倒在黎明前的黑暗?然而,2024 年3月,FDA支持Rexlemestrocel-L用於終末期射血分數降低( HFrEF )和植入左心室輔助裝置( LVAD )心衰患者的加速批准申請。
在前沿領域的創新需要堅持的勇氣。
不過,天士力從東方醫院引進的人臍帶間充質幹細胞注射液(B2278注射液),今年1月獲批开展心衰適應症的臨牀試驗。
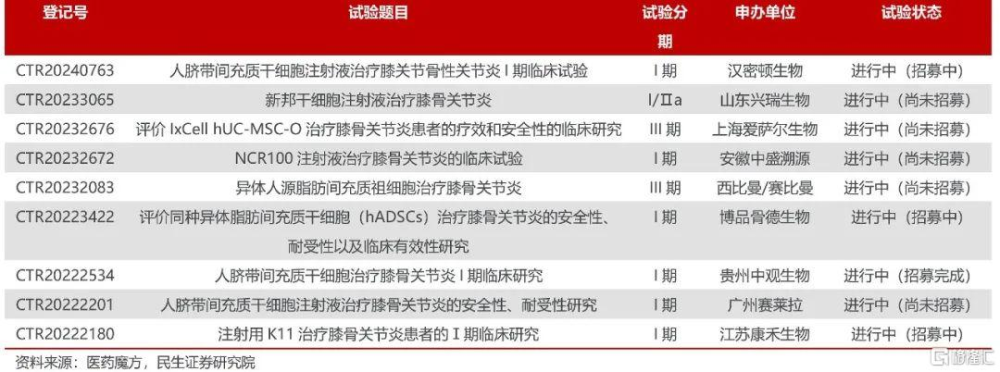 國內骨關節適應症幹細胞創新藥研發情況
國內骨關節適應症幹細胞創新藥研發情況
幹細胞療法圍攻關節炎大適應症。
骨關節炎( osteoarthritis,OA) 是一種嚴重影響患者生活質量的關節退行性疾病,隨着我國人口老齡化程度的不斷加劇,OA的患病率有逐漸上升的趨勢。據《中國骨關節炎診療指南(2021年版)》,我國40歲及以上人群不同年齡段原發性 OA 患病率分別爲:30.1%(40~49 歲)、48.7%(50~59歲)、62.2%(60~69歲)和62.1%(70歲以上);由此估算我國OA患病人數約有3.59 億。
2021 年9月6日,發表於《The Knee》的一項薈萃分析通過對 79 項(包含 8761名膝骨關節炎患者)的隨機對照臨牀試驗進行系統總結證實:在長達一年的隨訪中,幹細胞注射對膝骨關節炎患者的疼痛和功能有最大的改善作用,優於其他骨關節炎治療方式。
我武生物子公司我武幹細胞持續开展幹細胞領域的研究开發,完成自研完全培養基、分化培養基(成脂、成骨、成軟骨)的开發,相關培養基已應用於幹細胞治療骨關節炎項目中,正全力推進幹細胞治療藥物的臨牀前研究。
Biotech進度更快,西比曼與愛薩爾兩家均已开展III期臨牀。新三板上市公司賽萊拉人臍帶間充質幹細胞注射液治療膝骨關節炎新藥I 期臨牀試驗完成首例患者給藥。
針對缺血性腦卒中後偏癱是新興熱點。
ST 九芝堂子公司北京美科同種異體骨髓間充質幹細胞治療缺血性腦卒中處於I/ II期臨牀。據醫藥魔方數據,國內另有5家公司也在布局缺血性卒中幹細胞產品。
成藥性在日本得到驗證。由於腦細胞不可再生,針對慢性運動功能障礙及其他後遺症一直缺乏有效的治療手段,2024年7月,SanBio 开發的AKUUGO在日本獲批成爲全球首款用於此適應症的同種異體間充質幹細胞。
首家幹細胞Biotech上市公司能成嗎?
澤輝生物向港交所遞表,將申請主板掛牌上市。
核心產品ZH901處於臨牀II期階段,是國內首個也是唯一一個源自hESC(人胚幹細胞)的幹細胞來源細胞治療在研產品,爲可用現貨細胞制劑,且可於氣相液氮中穩定保存至少3年。
如前文所述胚胎幹細胞存在倫理爭議。用於新hESC系來源的胚胎是在父母雙方知情同意的情況下通過體外受精診所獲得。只有無法用於不孕治療的多余胚胎才能用於獲取hESC。然而,這種獲取通常需要破壞子宮外胚胎,此舉會引起倫理問題,在諸多國家爲法律所禁止。
澤輝生物還折射出一級市場Biotech的現金流危機。
2023年末,澤輝生物的現金及現金等價物爲1.67億元,而到今年8月底,已降至0.67億元,這意味着歷輪融資累計獲得的6.88億元已快燒完。
在另外一面,澤輝生物計劃10億元建設中山工廠,預計2024年底开工,2026年下半年完成,年產能約爲500000支細胞療法產品注射液。
奇跡會發生嗎?
標題:幹細胞开天闢地時刻
地址:https://www.iknowplus.com/post/159086.html







