中金:創新流感疫苗重塑海外競爭格局
多年來,標准滅活流感疫苗是全球範圍內使用最爲廣泛的流感疫苗類型,但其對流感病毒的預防效力仍有明顯的提升空間,這也成爲衆多新型流感疫苗的創新突破點。中金研究注意到海外已有多款創新流感疫苗上市,包括高劑量滅活流感疫苗、佐劑流感疫苗以及重組流感疫苗等,其憑借高保護效力方面的優勢保持穩定增長趨勢。據中金研究測算,2022年流感季海外新型流感疫苗銷售額佔比已經超過50%。中金研究在本篇報告中梳理了海外創新流感疫苗的發展趨勢與代表企業/產品,建議關注國內相關布局新型流感疫苗的企業。
摘要
創新流感疫苗拉動海外流感疫苗市場穩定擴容。海外流感疫苗市場近年來保持穩定增長,中金研究根據海外流感疫苗企業公告測算,2022年全球規模達約60億美元,2015-2022年CAGR約11%,其中新型流感疫苗約33億美元,2015-2022年CAGR超25%,佔比約56%。賽諾菲和CSL是海外流感疫苗市場的主要生產商,2022年市佔率分別爲53%和28%。賽諾菲採用差異化產品战略,旗下Fluzon高劑量流感疫苗和Flublok重組流感疫苗22年合計銷售額達18億歐元,佔其流感疫苗業務收入的60%。CSL同樣專注於創新疫苗,旗下Flucelvax細胞培養流感疫苗和Fluad佐劑流感疫苗22年分別佔其流感業務收入的37%和54%,合計銷售額達15億美元。考慮到創新疫苗的產品優勢以及海外流感疫苗龍頭的發力側重,預計未來創新流感疫苗佔有率仍將持續提升。
ACIP主要推薦創新流感疫苗用於65歲及以上老年人。美國免疫實施咨詢委員會(ACIP)推薦65歲及以上老年人優先推薦三款升級版本疫苗,即高劑量滅活流感疫苗、重組流感疫苗和佐劑流感疫苗。相比於標准流感疫苗,高劑量流感疫苗可將患流感的風險降低24%,而重組流感疫苗可降低30%,且重組流感疫苗安全性明顯優於高劑量滅活流感疫苗。佐劑流感疫苗整體有效性較好,但對H3N2的預防效力和安全性仍待提高。從目前披露臨牀數據分析,中金研究認爲重組流感疫苗的有效性和安全性較爲突出,其有望成爲未來流感疫苗升級的主要方向之一。
mRNA在流感疫苗的技術優勢和應用潛力需要更多證據。理論上mRNA研發及規模化生產效率高以及避免適應性突變的諸多優勢非常契合流感病毒疫苗的設計要求,但mRNA流感疫苗尚未展現出明顯優於標准流感疫苗的預防效力,且除mRNA-1010 (Moderna) 外的mRNA流感疫苗仍存在對乙型流感病毒反應較低等問題。中金研究建議關注mRNA-1010的上市申報進程,以及mRNA流感疫苗與其他呼吸道傳染病疫苗的聯合潛力。
風險
疫苗安全性風險,疫苗研發進度不及預期。
正文
核心總結
流感疫苗是目前全球第三大疫苗品類,傳統主流滅活路线在有效性等方面存在改進空間。按开發路徑區分,目前已上市流感疫苗包括流感滅活疫苗(包括雞胚培養和細胞培養)、流感減毒活疫苗和重組蛋白疫苗等。滅活疫苗生產工藝成熟、安全性高以及價格便宜,是全球範圍內使用最廣泛的流感疫苗;然而,據美國疾病預防控制中心[1](Centers for Disease Control and Prevention,CDC),目前主流滅活疫苗提供的保護力仍較低(若疫苗與流行毒株匹配,保護效力可達40-60%),特別是對老年人(65歲及以上)的保護率更低,且滅活流感疫苗對甲流H3N2的保護率有限,存在進一步改進的空間。
圖表1:海外疫苗市場拆分(2022年,按銷售額)
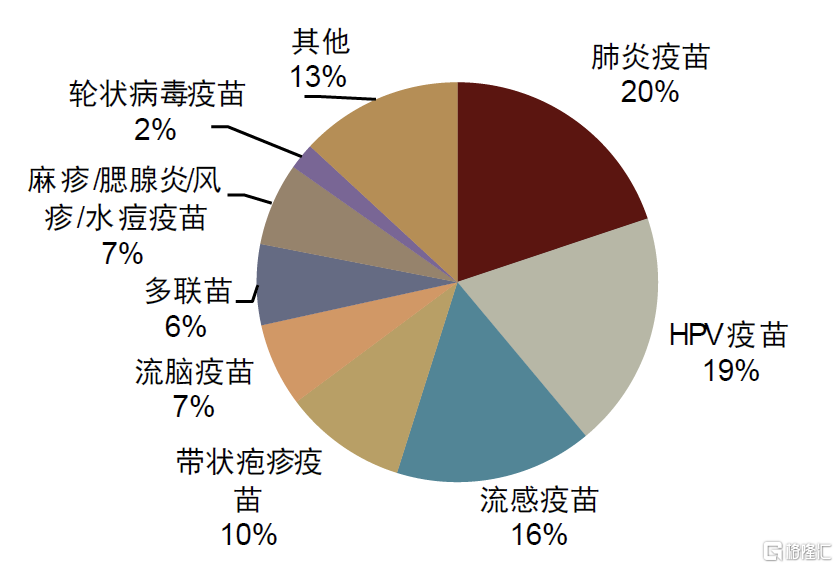
注:按照輝瑞、默沙東、GSK、賽諾菲、CSL、阿斯利康等企業公布疫苗收入計算資料來源:各公司公告,中金公司研究部
圖表2:海外流感疫苗市場拆分(2022年,按銷售額)
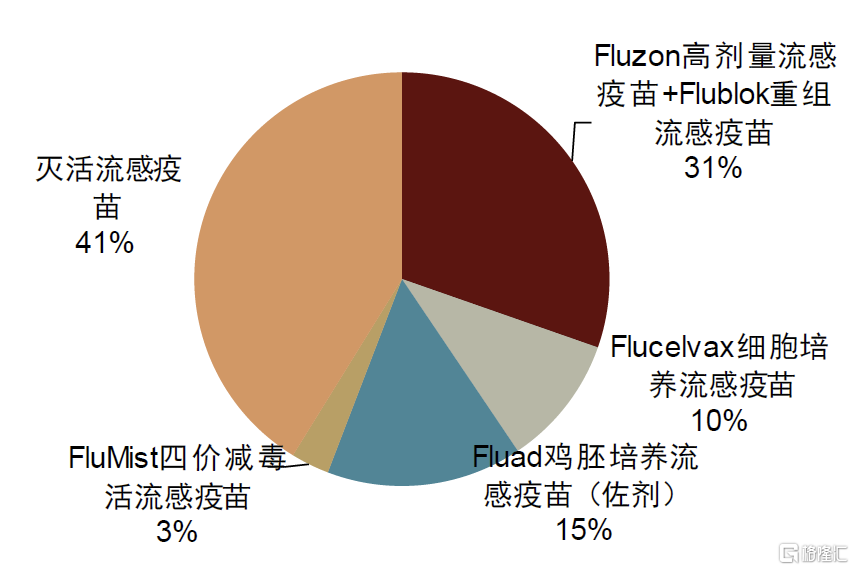
注:按照輝瑞、默沙東、GSK、賽諾菲、CSL、阿斯利康等企業公布疫苗收入計算
資料來源:各公司公告,中金公司研究部
爲解決滅活疫苗的不足,2009年以來已有多種新型流感疫苗先後被开發並推進至上市,目前正在逐漸替代傳統滅活疫苗成爲新的主流路线。
► 標准滅活流感疫苗(IIV):IIV是全球最主流的流感疫苗,生產工藝成熟,適用人群全面覆蓋兒童到老年人群,安全性表現優秀,且價格低廉,但該疫苗容易產生抗原性改變,對H3N2的預防效力較差,生產周期較長,雞胚相關成分也可能導致接種者出現過敏反應。
► 細胞培養流感疫苗(ccIIV):ccIIV是在IIV基礎上的升級類型,採用細胞培養替代傳統雞胚培養,克服了生產周期長和抗原性易改變的問題,但該疫苗保護力優勢不穩定,現有證據[2]顯示其更容易在H3N2流感季擁有更高的保護效力。
► 減毒活流感疫苗(LAIV):LAIV模仿流感病毒自然感染過程,通過鼻腔噴霧法接種,可同時激活粘膜免疫和全身性免疫反應,主要用於2-49歲人群接種。LAIV代表性產品爲阿斯利康的FluMist,其有效性和安全性與標准流感疫苗相當。
► 高劑量滅活流感疫苗(IIV-HD):IIV-HD疫苗含有4倍的抗原劑量,主要用於65歲及以上人群接種。與標准劑量流感疫苗相比,在50歲及以上成人中,高劑量流感疫苗可進一步降低24%患流感的風險,但該產品不良事件高於標准流感疫苗,且定價較高。IIV-HD代表性產品是Fluzon HD,已獲得ACIP推薦用於65歲及以上老年人。
► 佐劑流感疫苗(aIIV):aIIV代表性產品是Fluad,一款使用MF59創新佐劑的亞單位流感疫苗。該疫苗在65歲及以上人群的保護效力優於標准疫苗,但該疫苗的接種後不良反應也明顯多於標准疫苗。該疫苗仍採用雞胚培養技術,對H3N2的預防效力較低。該產品定價與Fluzon HD類似,均高於標准流感疫苗。
► 重組流感疫苗(RIV):RIV採用杆狀病毒表達系統生產血凝素抗原,保證疫苗和野生型流行流感病毒血凝素完全一致。代表性產品是Flublok,其含有3倍的抗原劑量,與標准劑量四級流感疫苗相比,在50歲及以上成人中,重組四價流感疫苗可進一步降低30%患流感的風險,且安全性表現與准劑量流感疫苗類似。Flublok可用於18歲及以上人群接種,但其定價也高於標准流感疫苗。
圖表3:各類流感疫苗對比
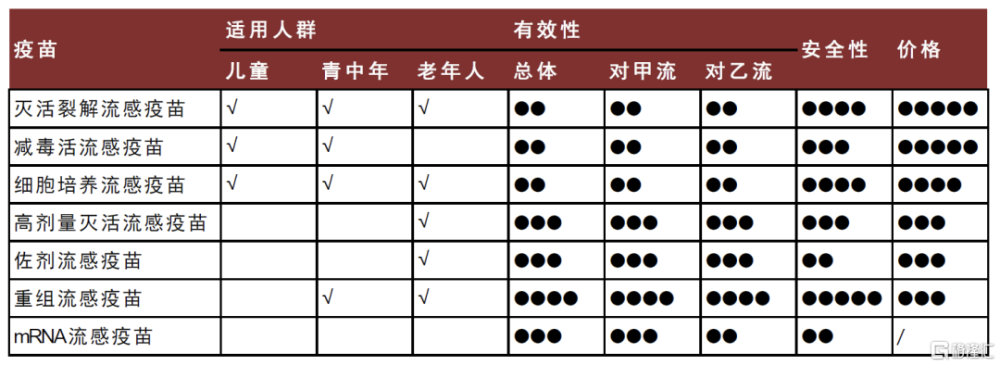
注:√代表該適應人群已獲批;●越多,表示疫苗在該項評價上表現越好 mRNA流感疫苗的適用人群和定價待獲批上市後確定。 資料來源:中金公司研究部
中國流感疫苗研發仍處於對標追趕階段。整體上看,海外賽諾菲、CSL、Moderna等疫苗企業均已將流感疫苗研發重心轉向重組蛋白、mRNA等非蛋類流感疫苗制造技術,海外較高的疫苗接種率和成熟的保險支付環境也爲創新流感疫苗的商業化創造了條件。國內市場目前仍以滅活流感疫苗爲主,同時亦有個別企業正在开發細胞培養流感疫苗,但對重組流感疫苗和mRNA流感疫苗的布局仍較有限。
國內流感疫苗接種意識處於提升階段,關注後續接種率變化。受限於居民對流感的認識不足以及流感疫苗的自費屬性,國內流感疫苗的接種率[3]常年維持在3-5%的較低水平,國內流感疫苗的商業化潛力仍有待釋放。中金研究注意到近兩年國內流感疾病負擔較重,疊加各地政府陸續推出流感疫苗免費接種政策,流感疫苗的供給能力亦有所加強,居民的流感疫苗接種意愿逐步提升。考慮到滅活流感疫苗安全性可靠和價格便宜的特點,中金研究認爲其仍是現階段國內流感疫苗推廣普及的優先選擇之一,但國內企業對新型流感疫苗的布局與开發也值得關注。
中性假設下,預計國內流感疫苗市場規模有望達到110億元,對應全人口接種率約9%。預計各年齡組流感疫苗接種率相較2020-21年流感季增加一倍,疫苗平均價格下滑到80-90元/劑,則國內流感疫苗市場規模爲110億元。值得注意的是,參考海外新型流感疫苗定價往往高於標准流感疫苗,中金研究認爲未來新型流感疫苗上市後有望進一步擴容市場規模。
從美國流感疫苗升級歷史看國內迭代方向
在美國市場,新型流感疫苗近年來正逐步取代傳統滅活疫苗。據國內外流感疫苗接種指南,接種流感疫苗是預防流感相關感染、減少住院及預防死亡最有效的策略。20世紀30年代,流感病毒被發現可在胚胎卵中培養,而後以滅活裂解爲代表的傳統流感疫苗被开發上市並成長爲全球最大的疫苗品類之一;隨着行業的發展,更多創新疫苗技術被運用於流感疫苗开發並陸續有產品上市。以流感疫苗接種政策及品類相對完善的美國市場爲例,目前已有5種不同路徑的創新流感疫苗上市,據美國CDC,2022-2023年其接種市佔率已達20%。本篇報告通過復盤美國流感疫苗技術升級迭代歷史,爲未來國內流感行業投資方向提供參考。
流感疫苗研發歷史:創新流感疫苗瞄准滅活流感疫苗有效性不足、潛在雞蛋過敏和生產周期長的痛點
雞胚生產滅活流感疫苗(IIV)是全球最早成功开發的流感疫苗,也是目前應用最廣的技術路线。20世紀40年代,科學家通過將流感病毒接種於雞胚尿囊腔中,病毒成熟後收集尿囊液,經歷滅活、離心、濃縮、純化後得到病毒原液,开發了最早的流感全病毒滅活疫苗,此類疫苗於1948年在美國上市;在流感全病毒滅活疫苗基礎上,通過裂解去除病毒核酸和大分子蛋白質,僅保留有效抗原成分可制得滅活流感疫苗,此類疫苗於1968年率先在美國上市,至今仍是全球使用最爲廣泛的流感疫苗類型,2023年美國使用率約80%(據美國CDC),中國使用率超過95%(中金研究根據中國中檢院批籤發數據測算)。20世紀50年代,科學家在裂解流感疫苗基礎上,通過進一步裂解抗原成分並提純,得到了流感病毒亞單位疫苗,進一步改善了安全性。
滅活流感疫苗技術早在20世紀50年代便已成熟,但始終未能突破流感病毒抗原性易變和雞胚生產技術限制條件較多等挑战:1)在滅活流感疫苗生產過程中,連續的流感病毒(例如H3N2)傳代可導致抗原位點的卵適應性突變,導致抗原性改變,從而降低疫苗的有效性;2)雞胚生產滿足量產條件至少需要3-4個月,在流行亞型預測失准的情況下不具備臨時改進的能力,且雞胚質量和供應量會直接影響疫苗供應。根美國CDC,2022-23年流感季節,流感疫苗在65歲及以上人群中的保護效力爲35%。
圖表4:流感疫苗發展關鍵節點
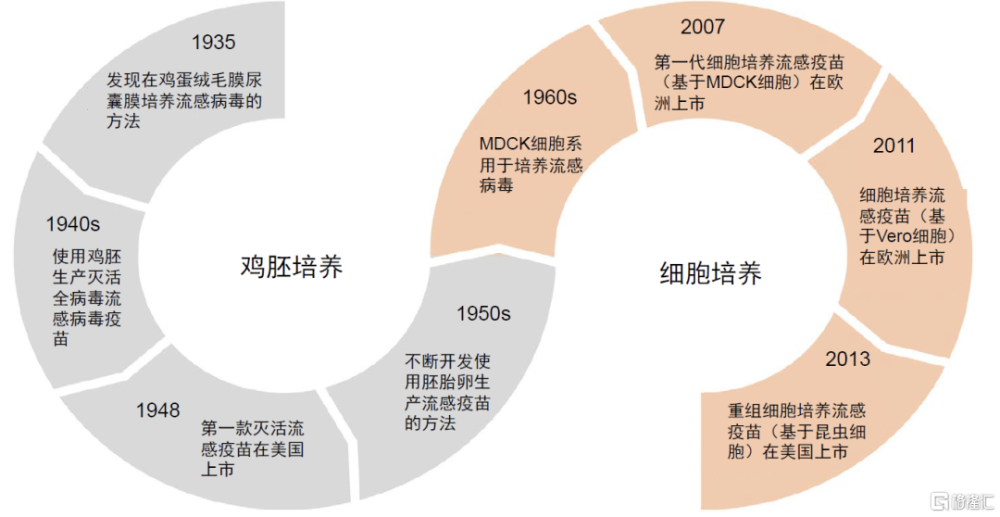
資料來源:Reviews in Medical Virology,中金公司研究部
爲了克服上述缺點,國內外流感疫苗企業轉向新型流感疫苗研發。20世紀60年代,科學家發現哺乳動物細胞可替代雞胚生產流感病毒,其中代表性細胞株是MDCK(Madin–Darby canine kidney)細胞系。基於MDCK細胞系开發,2007年全球第一款基於細胞培養的流感疫苗(Flucelvax)率先在歐洲上市。Flucelvax仍採用病毒傳代培養的方式生產全病毒,疫苗的主要活性成分血凝素與其他非活性成分混合存在,而人體基於血凝素產生的中和抗體才是對抗流感病毒主要工具,因此細胞培養路线仍有提升空間。隨後,科學家採用杆狀昆蟲病毒表達系統和重組DNA技術直接生產流感病毒血凝素抗原,用於制造重組流感疫苗,並於2013年在美國率先上市,該疫苗領先的技術路线也爲其帶來保護率高和安全性好的雙重優勢。
截至目前,美國已上市的新型流感疫苗包括高劑量滅活流感疫苗(Fluzone High-Dose Quadrivalent),佐劑流感疫苗(Fluad Quadrivalent),細胞培養流感疫苗(Flucelvax Quadrivalent),以及重組流感疫苗(Flublok Quadrivalent);在研品種包括mRNA疫苗、腺病毒載體疫苗、病毒樣顆粒疫苗以及通用型疫苗等。
圖表5:美國上市流感疫苗(2022-2023年流感季)
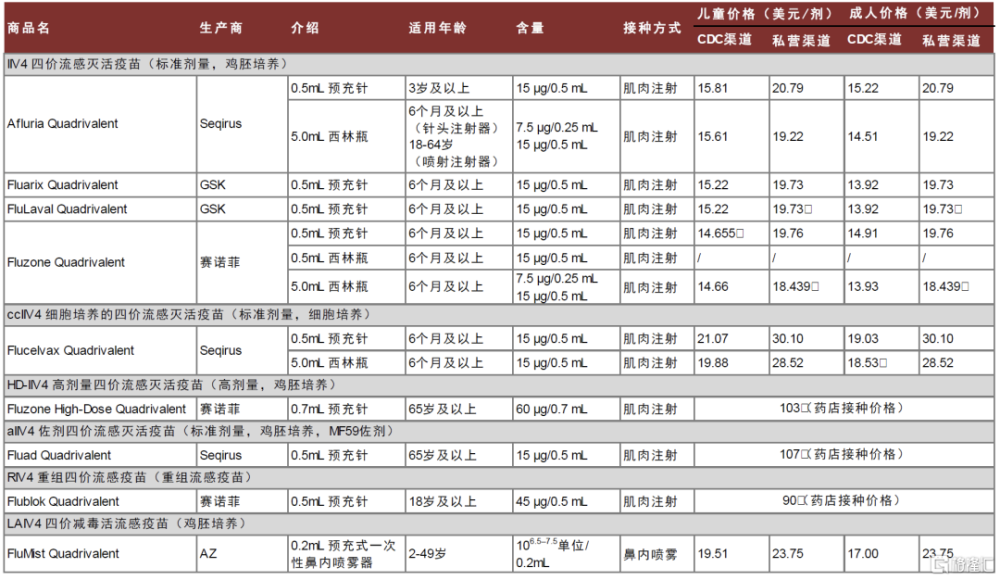
資料來源:美國CDC,中金公司研究部
美國CDC對流感疫苗持無差別推薦態度,針對老年人的流感疫苗除外。自2010年以來,美國CDC和免疫實踐咨詢委員會(ACIP)建議對所有年齡≥6個月且無禁忌症的人進行常規年度流感疫苗接種。2022年6月,ACIP一致投票決定向65歲及以上老年人優先推薦三款升級版本疫苗,即Fluzon高劑量四價流感疫苗、Flublok四價重組流感疫苗和Fluad四價佐劑流感疫苗。
得益於可爲老年人提供更有效的保護力,這三款疫苗近幾年銷售額保持穩步提升,並逐步取代傳統滅活裂解流感疫苗。根據美國FDA數據,近年來三款老年人推薦疫苗的批籤發批次佔比逐步提升至40%左右,其中Flublok四價重組流感疫苗佔比提升至20%,Fluad四價佐劑流感疫苗佔比提升至15%。
圖表6:全球流感疫苗銷售收入(未包括國內流感疫苗企業,2011-2022年)
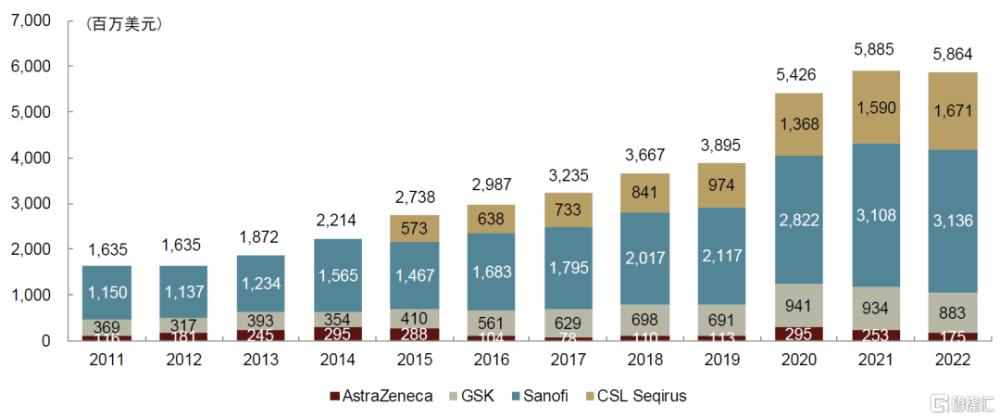
注:CSL未公告2015年之前流感疫苗收入 資料來源:各公司公告,中金公司研究部
圖表7:美國流感疫苗批籤發批次
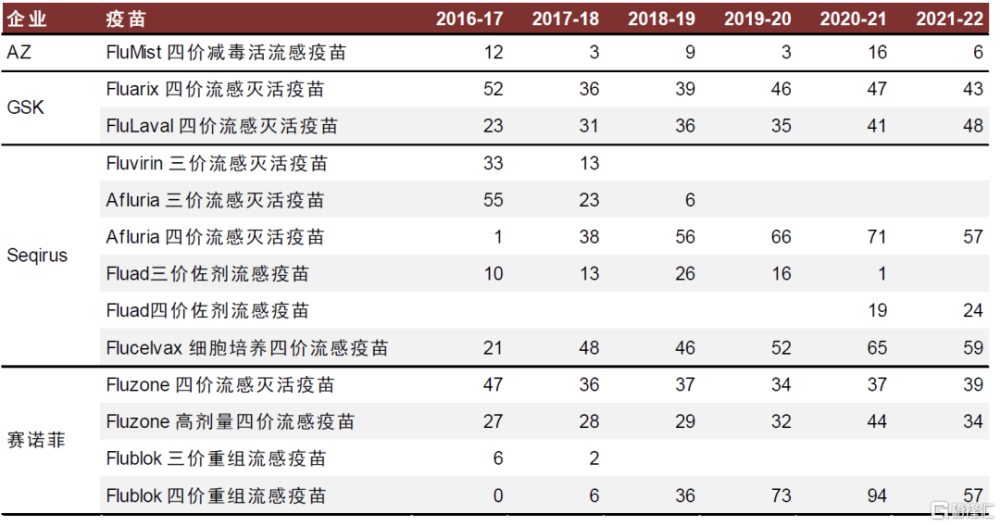
注:美國流感疫苗批籤發批次與國內類似,不同批次包括疫苗數量不等,該數據僅供參考 資料來源:FDA,中金公司研究部
圖表8:美國流感疫苗批籤發批次佔比
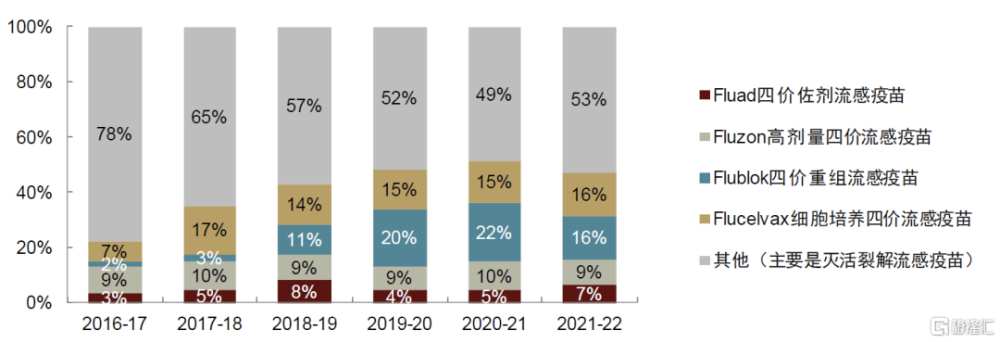
資料來源:美國FDA,中金公司研究部
復盤賽諾菲流感業務,高劑量滅活疫苗和重組蛋白疫苗已成爲核心增長點
賽諾菲是全球流感疫苗龍頭,全球市場份額超50%。1948年美國賓夕法尼亞州斯威沃特的Pocono生物實驗室(今屬賽諾菲巴斯德)誕生了第一支流感疫苗,至今公司流感疫苗已在全球擁有70年使用歷史,並在在全球100多個國家上市。目前公司已在在全球擁有法國、美國、加拿大、墨西哥和中國深圳五大流感疫苗生產基地,每年爲全球提供超過2.5億劑的流感疫苗。公司致力於不斷改進流感疫苗研發,已擁有滅活裂解、重組蛋白、mRNA(在研)等多個流感疫苗生產平台。
圖表9:賽諾菲流感業務收入情況(2018-2022)
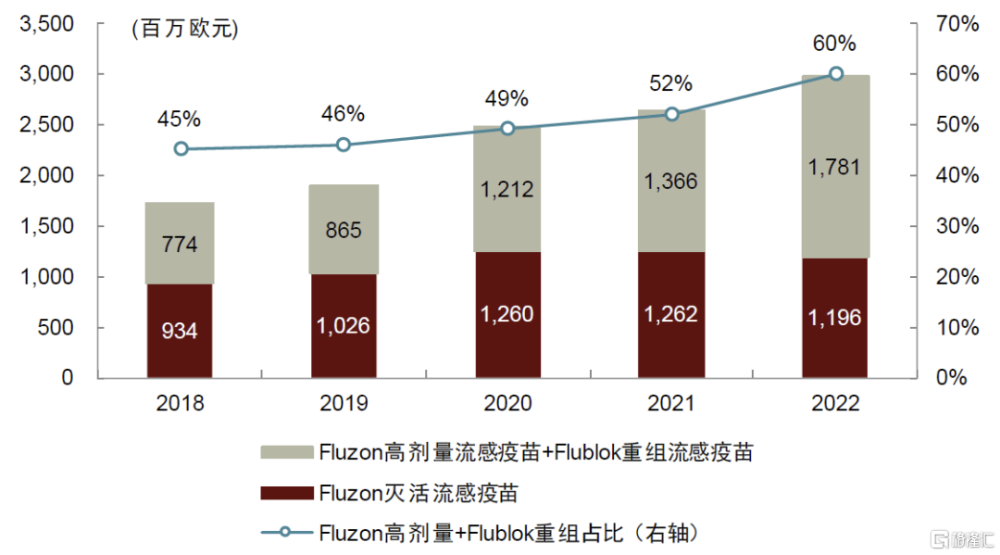
資料來源:公司公告,中金公司研究部
公司近年來持續拓展非蛋類流感疫苗制造技術,以通過差異化產品战略不斷強化其在流感疫苗領域的領先地位。如前文所述,公司滅活流感疫苗始終未能解決抗原性突變和生產限制多的問題,導致其在流感易感人群中——特別是老年人中——的預防效力較低。爲提高流感疫苗在老年人的免疫應答和保護效果,賽諾菲直接將疫苗中每種抗原組分的含量由標准的15ug提高到60ug,於2009年推出了Fluzon高劑量滅活流感疫苗(對流感保護效力比 Fluzone滅活疫苗高24%)。但Fluzon在提升保護效力的同時,也帶來了更加明顯的安全性問題,因此公司繼續探索替代傳統雞胚生產的創新技術。2017年,公司通過收購Protein Sciences獲得Flublok重組流感疫苗(對流感保護效力比 Fluzone滅活疫苗高30%,且安全性與標准流感疫苗類似),解決了老年人流感疫苗安全性不足的缺陷。目前這兩款產品已成爲公司流感業務的核心增長點,2022年來合計佔公司流感疫苗業務收入的60%。
圖表10:賽諾菲的流感疫苗發展歷程
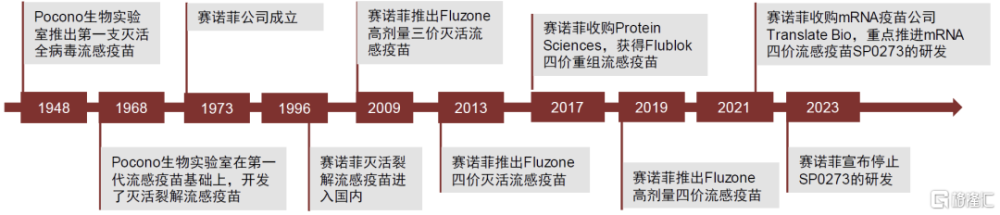
資料來源:公司公告,中金公司研究部
Fluzon高劑量流感疫苗:流感保護效力提升24%,安全性仍有改良空間
Fluzon高劑量流感疫苗免疫原性具備優勢,但安全性尚有提升空間。FDA在2009年批准了賽諾菲的Fluzone高劑量三價流感疫苗,適用於65歲及以上老年人,並在2019年批准了Fluzone高劑量四價流感疫苗。與標准劑量流感疫苗相比,高劑量流感疫苗含有4倍的抗原劑量[4],其接種後誘導產生的A/H1N2和A/H3N2 HAI(hemagglutination inhibition test, 血凝抑制試驗)滴度明顯提高,但對乙型流感病毒僅爲非劣。研究4顯示,在65歲及以上成人中,高劑量流感疫苗可進一步降低24%患流感的風險。2018-2019年流感季,賽諾菲爲美國提供了1.12億劑量Fluzone高劑量流感疫苗,接種流感疫苗的65歲及以上人群中約2/3選擇了該款產品;近年來Fluzone高劑量疫苗的佔比持續下滑,預計主要受到了其他老年人流感疫苗的放量衝擊。
值得注意的是,目前美國使用的Fluzone高劑量四價流感疫苗安全性和Fluzone高劑量三價流感疫苗類似,其接種後常見不良反應包括注射部位疼痛(41.3%)、肌肉疼痛(22.7%)、頭痛(14.4%)和不適(13.2%),高於標准流感疫苗。不良反應通常出現在接種疫苗前三天內,大多數症狀會自行緩解。此外,Fluzon高劑量流感疫苗定價也明顯高於標准劑量。
圖表11:Fluzone高劑量在美國65歲及以上老年人流感疫苗中的市場份額
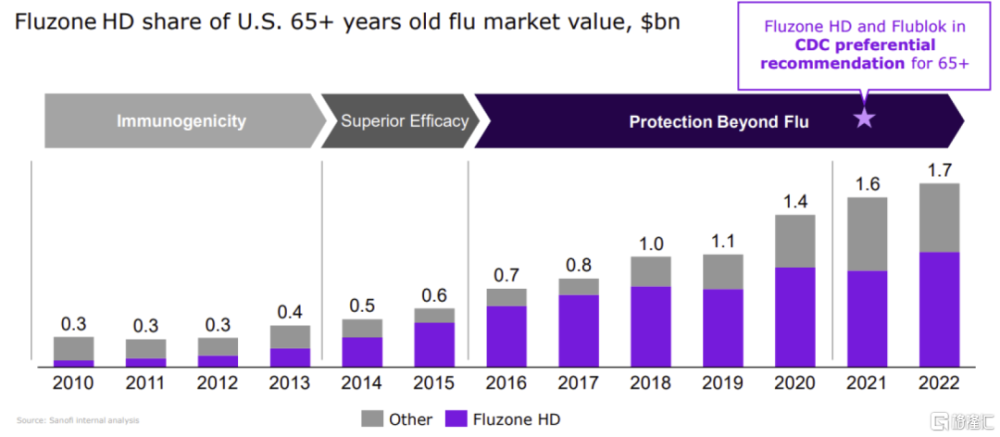
資料來源:公告公告,中金公司研究部
圖表12:Fluzon高劑量流感疫苗對甲/乙型流感的預防效力
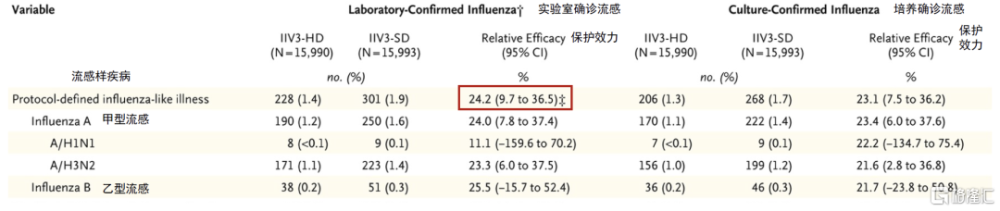
注:IIV3-HD,Fluzone高劑量三價流感疫苗;IIV3-HD,標准三價流感疫苗 資料來源:DiazGranados CA, Dunning AJ, Kimmel M, Kirby D, Treanor J, Collins A, Pollak R, Christoff J, Earl J, Landolfi V, Martin E, Gurunathan S, Nathan R, Greenberg DP, Tornieporth NG, Decker MD, Talbot HK. Efficacy of high-dose versus standard-dose influenza vaccine in older adults. N Engl J Med. 2014 Aug 14;371(7):635-45. doi: 10.1056/NEJMoa1315727. PMID: 25119609.,中金公司研究部
圖表13:Fluzone高劑量三價流感疫苗和Fluzone三價流感疫苗接種後7天局部和全身不良反應對比
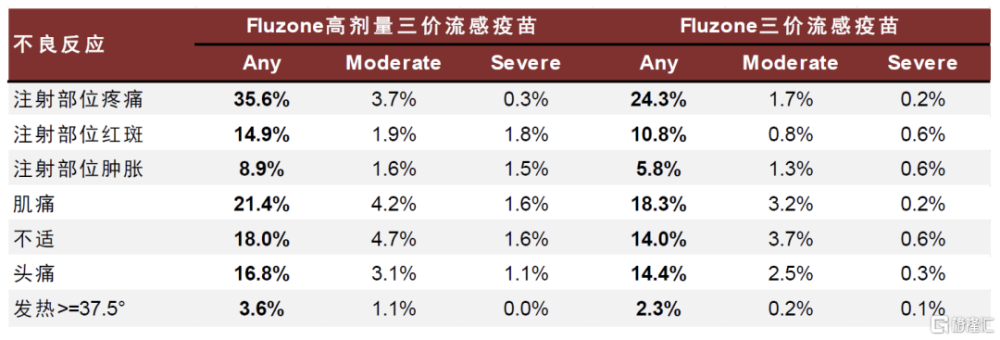
注:65歲及以上人群 資料來源:Falsey AR, Treanor JJ, Tornieporth N, Capellan J, Gorse GJ. Randomized, double-blind controlled phase 3 trial comparing the immunogenicity of high-dose and standard-dose influenza vaccine in adults 65 years of age and older. J Infect Dis. 2009 Jul 15;200(2):172-80.,中金公司研究部
Flublok重組流感疫苗:流感保護效力提升30%,安全性良好
Flublok是全球首款上市的重組蛋白流感疫苗。Protein Sciences开發了用於重組蛋白質生產的杆狀病毒表達系統技術(BEVS)平台,並運用此平台成功开發了Flublok重組流感疫苗。Flublok三價重組流感疫苗在2013年1月獲FDA批准上市,適用於19-49歲人群預防季節性流感,隨後2014年10月適用人群拓展至18歲及以上人群。迭代產品Flublok四價重組流感疫苗於2016年10月獲FDA批准上市,用於18歲及以上成年人針對季節性流感的主動免疫。2017年8月,賽諾菲支付6.5億美元首付款和1億美元裏程碑付款100%收購Protein Sciences,將Flublok四價流感疫苗納入公司流感疫苗資產。
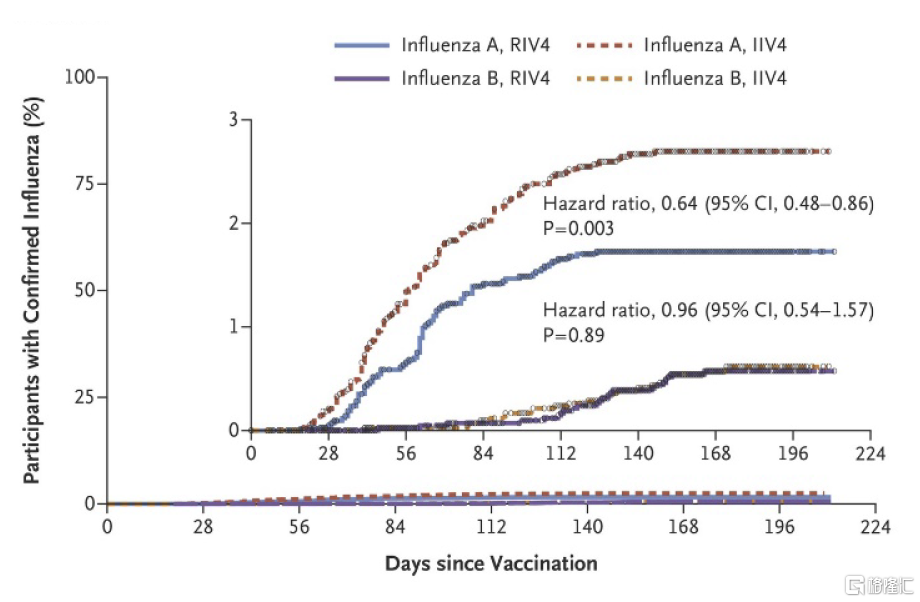
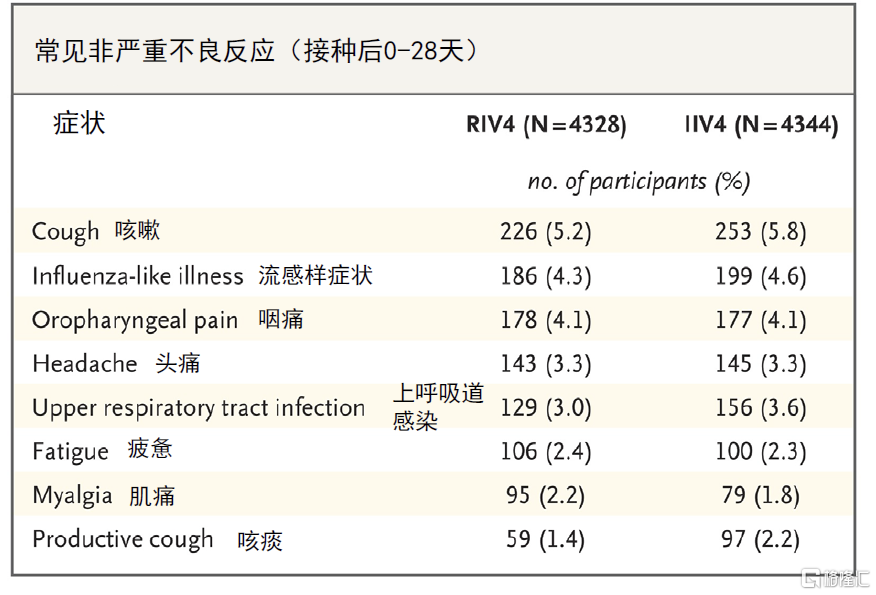
Flublok四價流感疫苗免疫原性優勢突出,且安全性良好。不同於傳統雞胚生產的流感疫苗,重組四價流感疫苗採用昆蟲細胞生產流感病毒特異性抗原,可降低生產過程中毒株發生適應性突變引起的疫苗株匹配度下降和疫苗有效性較低的風險,能夠更好保證所生產的疫苗與WHO每年推薦的流感疫苗生產毒株達到精確的基因匹配。與標准劑量流感疫苗相比,該疫苗含有3倍的抗原劑量,接種後其誘導的針對A/H1N2和A/H3N2的HAI滴度明顯提高,對乙流也有小幅度提高;研究顯示[5]在50歲及以上成人中,重組四價流感疫苗較標准流感疫苗可進一步降低30%患流感的風險。此外,該疫苗不良反應風險和標准劑量四價流感疫苗類似。
圖表14:Flublok(RIV4)對甲/乙型流感的預防效力
資料來源:Dunkle LM, Izikson R, Patriarca P, Goldenthal KL, Muse D, Callahan J, Cox MMJ; PSC12 Study Team. Efficacy of Recombinant Influenza Vaccine in Adults 50 Years of Age or Older. N Engl J Med. 2017 Jun 22;376(25):2427-2436. doi: 10.1056/NEJMoa1608862. PMID: 28636855.,中金公司研究部
圖表15:Flublok(RIV4)的安全性數據
資料來源:Dunkle LM, Izikson R, Patriarca P, Goldenthal KL, Muse D, Callahan J, Cox MMJ; PSC12 Study Team. Efficacy of Recombinant Influenza Vaccine in Adults 50 Years of Age or Older. N Engl J Med. 2017 Jun 22;376(25):2427-2436. doi: 10.1056/NEJMoa1608862. PMID: 28636855.,中金公司研究部
杆狀病毒表達載體系統(BEVS)是重組流感疫苗开發成功的關鍵。BEVS是一種利用杆狀病毒作爲外源基因表達系統,可通過替換病毒中的非必需基因來實現外源基因的擴增和蛋白表達。該系統主要由轉移質粒、杆狀病毒載體和昆蟲宿主細胞系組成,先借助E.coli細胞系將外源基因導入杆狀病毒載體,隨後讓杆狀病毒載體在昆蟲宿主細胞系中表達目的蛋白,用於制作疫苗。與傳統的疫苗生產平台相比,BEVS平台具備制造速度快、產品設計靈活、安全性高、可擴展性強的優點。以流感疫苗生產爲例,雞胚流感疫苗生產至少需要3-4個月,而BEVS衍生的流感疫苗只需要1.5個月,且能夠保證目的基因的完整轉錄和修飾。目前BEVS已成功應用於10余種疫苗开發,包括Cervarx(GSK 2價HPV疫苗)、Flublol、NVX-CoV2373(Novavax新冠疫苗)等。
圖表16:基於杆狀病毒表達載體系統(BEVS)的疫苗制備過程
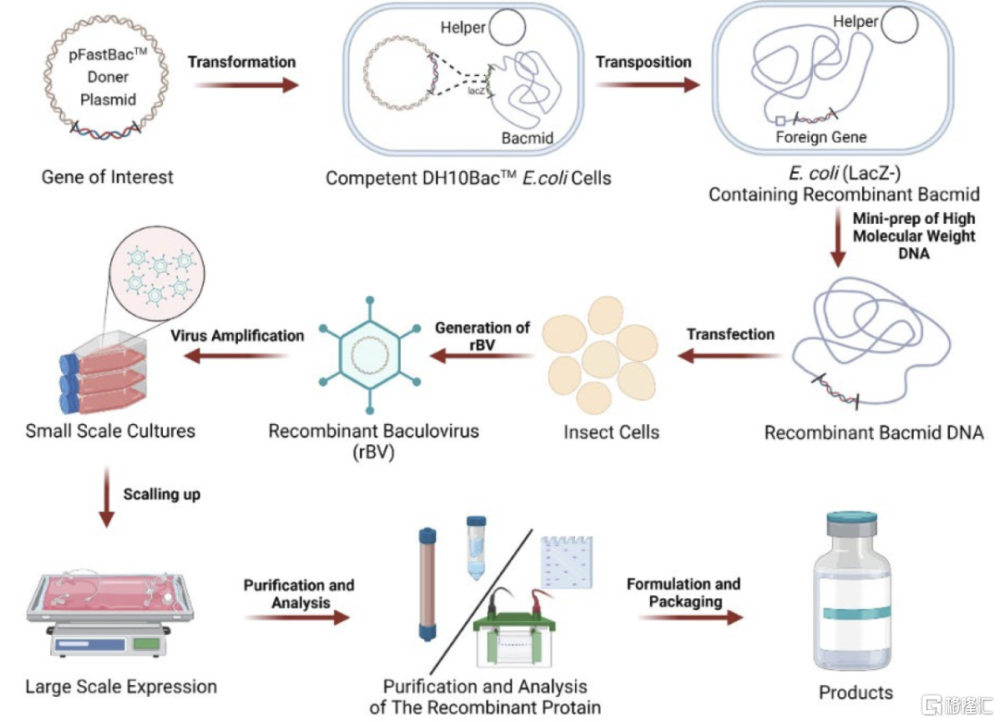
資料來源:Hong, Q., Liu, J., Wei, Y., & Wei, X. (2023). Application of Baculovirus Expression Vector System (BEVS) in Vaccine Development. Vaccines, 11.,中金公司研究部
復盤CSL Seqirus流感業務,細胞培養流感疫苗和佐劑流感疫苗穩定成長
CSL Seqirus是全球第二大流感疫苗生產商。2014年CSL通過收購諾華旗下的全球流感疫苗業務取得雞胚培養和細胞培養流感疫苗技術,以及專有的佐劑平台,並於2015年將該部門與CSL的子公司bioCSL合並,聯合企業更名爲Seqirus。CSL目前在美國、英國和加拿大建立三大流感疫苗生產基地,每年可爲全球20多個國家/地區提供超1億劑流感疫苗。
圖表17:CSL Seqirus流感疫苗業務收入拆分
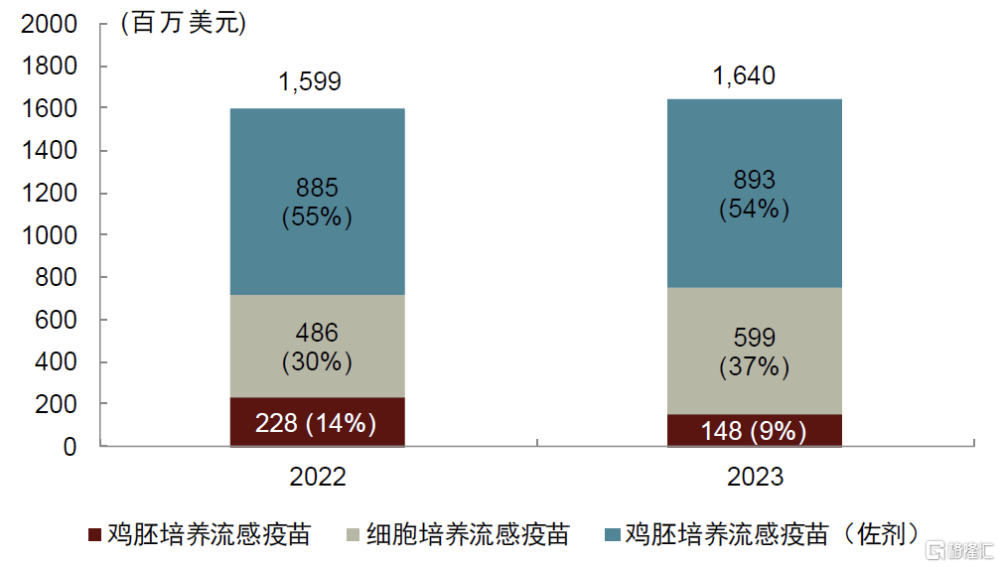
資料來源:公司公告,中金公司研究部
CSL Seqirus基本直接沿用了諾華疫苗業務的技術路线。1990年开始,海外許多公司致力於研究新型佐劑,以提高疫苗的保護效力;諾華早在1992年成功开發了MF59佐劑,並將MF59應用於佐劑流感疫苗Fluad,該疫苗最早於1997年在意大利上市,並於2015年在美國上市。爲進一步提高疫苗業務競爭力,諾華於2006年並購了美國疫苗巨頭Chiron,此時Chiron是僅次於賽諾菲的美國第二大流感疫苗供應商,主要產品是FlurVirin(三價滅活流感疫苗,1988年獲FDA批准上市)。2009年全球甲型H1N1流感大流行,各國急需流感疫苗,但基於雞胚生產的滅活流感疫苗難以在短時間內大量生產。該事件後,各國政府和疫苗公司开始積極推動流感疫苗生產工藝的進步。2012年諾華的Flucelvax細胞培養流感疫苗獲FDA批准上市,旨在流感大流行時可快速建立疫苗儲備。CSL收購諾華流感疫苗後,繼續推進Flucelvax細胞培養流感疫苗和Fluad佐劑流感疫苗的商業化拓展,目前兩款產品已成長爲CSL流感業務的核心增長點,2022年Flucelvax佔公司流感疫苗業務收入的37%,Fluad佔54%。
圖表18:CSL的流感疫苗發展歷程
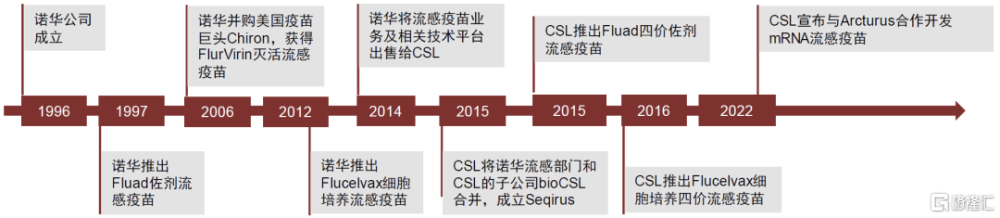
資料來源:公司公告,中金公司研究部
Flucelvax細胞培養流感疫苗:安全性良好,但保護力優勢不穩定
Flucelvax細胞培養流感疫苗對不同流行毒株的保護力優勢差距較大,安全性良好。Flucelva最早由諾華开發,2012年獲FDA批准上市,適用於6個月及以上人群。Flucelva基於MDCK(Madin–Darby canine kidney)細胞系开發,MDCK細胞系被公認爲最適合流感病毒毒株分離和疫苗生產的細胞系之一,流感病毒可在MDCK細胞中迅速復制,在3-10代內即可獲得高產病毒株,縮短疫苗生產時間並降低傳代過程中適應性突變的可能性。此外,該細胞系較易於適應無血清培養基,以及無血清懸浮馴化,有利於大規模產業化生產。據美國CDC,在2017-2018年流感季,針對65歲及以上人群,基於細胞培養的流感疫苗可提供更好的保護效力,但是在2018-2019年和2019-202年流感季未觀察到該差異。現有證據提示細胞生產流感疫苗更可能在H3N2流感季擁有更高的保護效力。
圖表19:2017-2018年流感季,針對流感相關住院的流感疫苗相對有效性
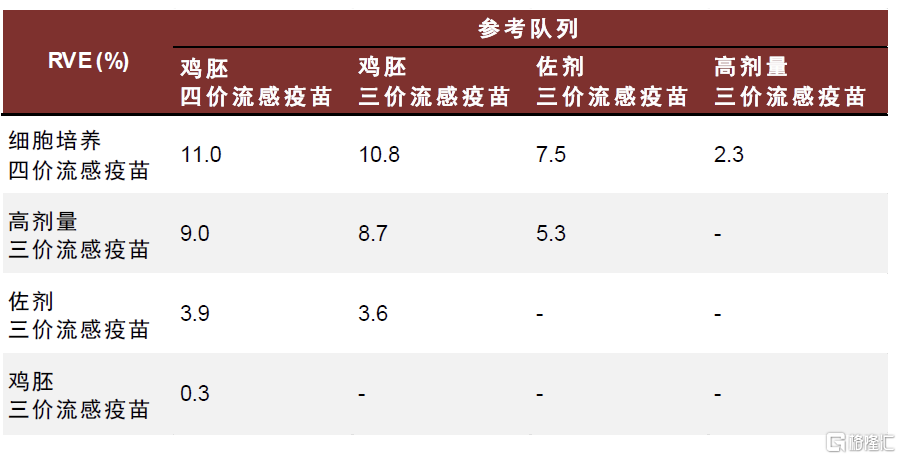
注:RVE,相對疫苗保護率,即相對參考隊列的疫苗保護率,值越大代表相對參考疫苗的保護率越高資料來源:Hector S Izurieta, Yoganand Chillarige, Jeffrey Kelman, Yuqin Wei, Yun Lu, Wenjie Xu, Michael Lu, Douglas Pratt, Steve Chu, Michael Wernecke, Thomas MaCurdy, Richard Forshee, Relative Effectiveness of Cell-Cultured and Egg-Based Influenza Vaccines Among Elderly Persons in the United States, 2017–2018, The Journal of Infectious Diseases, Volume 220, Issue 8, 15 October 2019, Pages 1255–1264,中金公司研究部
圖表20:2018-2019年流感季,針對流感相關住院的流感疫苗相對有效性
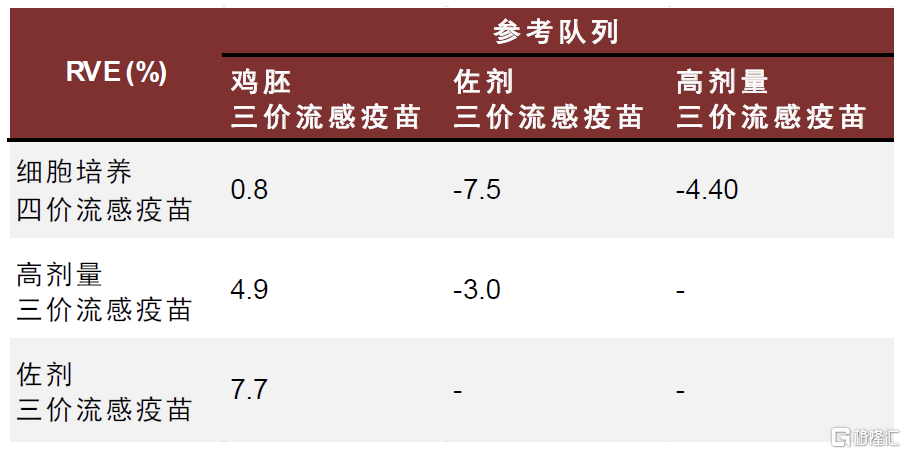
注:RVE,相對疫苗保護率,即相對參考隊列的疫苗保護率,值越大代表相對參考疫苗的保護率越高
資料來源:Hector S Izurieta, Yoganand Chillarige, Jeffrey Kelman, Yuqin Wei, Yun Lu, Wenjie Xu, Michael Lu, Douglas Pratt, Michael Wernecke, Thomas MaCurdy, Richard Forshee, Relative Effectiveness of Influenza Vaccines Among the United States Elderly, 2018–2019, The Journal of Infectious Diseases, Volume 222, Issue 2, 15 July 2020, Pages 278–287,中金公司研究部
圖表21:Flucelvax細胞培養三價流感疫苗安全性數據
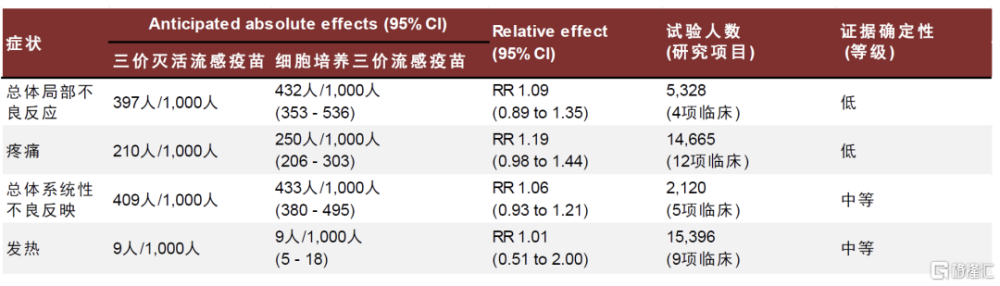
注:ccIIV3: cell-based trivalent inactivated influenza vaccine; CI: Confidence interval; IIV3: trivalent inactivated influenza vaccine; RR: Risk ratio 資料來源:O Murchu E, Comber L, Jordan K, Hawkshaw S, Marshall L, O'Neill M, Ryan M, Teljeur C, Carnahan A, Pérez JJ, Robertson AH, Johansen K, Jonge J, Krause T, Nicolay N, Nohynek H, Pavlopoulou I, Pebody R, Penttinen P, Soler-Soneira M, Wichmann O, Harrington P. Systematic review of the efficacy, effectiveness and safety of MF59® adjuvanted seasonal influenza vaccines for the prevention of laboratory-confirmed influenza in individuals ≥18 years of age. Rev Med Virol. 2023 May;33(3):e2329.,中金公司研究部
Fluad佐劑流感疫苗:保護力優於標准疫苗,安全性尚可
Fluad佐劑流感疫苗預防效力略高於標准疫苗,安全性尚可。Fluad是諾華生產的含創新佐劑MF59的亞單位流感疫苗,於1997年在意大利首次獲得批准,隨後於2015年在美國和歐洲獲得批准,用於65歲及以上人群。此外,Fluad四價流感疫苗也已被批准用於該老年人群,並在美國2020-2021年季節上市。MF59 是一種水包油的乳劑,包含1%鯊烯,0.5%吐溫80和0.5%三油酸聚山梨脂的水包油乳液,可明顯增強疫苗誘導的體液免疫,也可誘導產生一定的Th1/2型細胞免疫。
得益於MF59佐劑,Fluad佐劑流感疫苗可提供較強的保護力,美國CDC指出該疫苗在65歲及以上人群的保護效力優於標准疫苗,但該疫苗的接種後不良反應也明顯多於標准疫苗。值得注意的是,Fluad仍採用雞胚培養技術,未能克服此類疫苗對H3N2預防效力較低的缺點。
圖表22:Fluad佐劑三價流感疫苗有效率數據
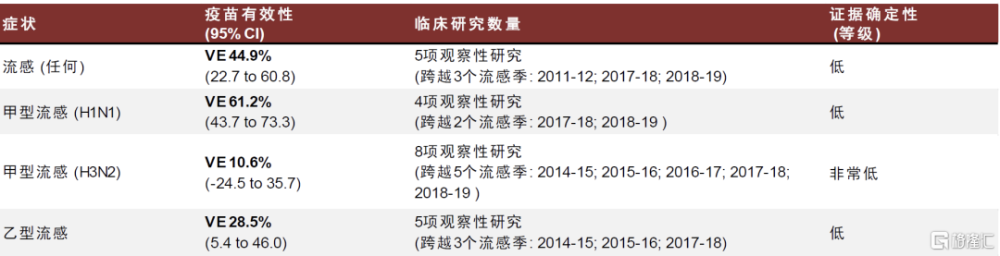
注:aIIV3: adjuvanted trivalent inactivated influenza vaccine; CI: Confidence interval 資料來源:O Murchu E, Comber L, Jordan K, Hawkshaw S, Marshall L, O'Neill M, Ryan M, Teljeur C, Carnahan A, Pérez JJ, Robertson AH, Johansen K, Jonge J, Krause T, Nicolay N, Nohynek H, Pavlopoulou I, Pebody R, Penttinen P, Soler-Soneira M, Wichmann O, Harrington P. Systematic review of the efficacy, effectiveness and safety of MF59® adjuvanted seasonal influenza vaccines for the prevention of laboratory-confirmed influenza in individuals ≥18 years of age. Rev Med Virol. 2023 May;33(3):e2329.,中金公司研究部
圖表23:Fluad佐劑三價流感疫苗安全性數據
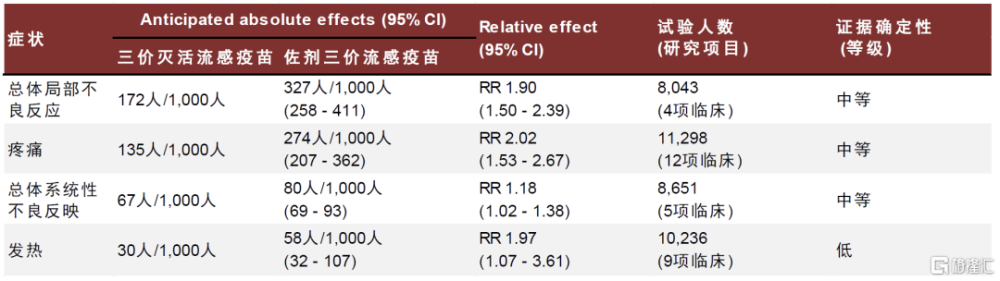
注:aIIV3: adjuvanted trivalent inactivated influenza vaccine; CI: Confidence interval; IIV3: trivalent inactivated influenza vaccine; RR: Risk ratio 資料來源:O Murchu E, Comber L, Jordan K, Hawkshaw S, Marshall L, O'Neill M, Ryan M, Teljeur C, Carnahan A, Pérez JJ, Robertson AH, Johansen K, Jonge J, Krause T, Nicolay N, Nohynek H, Pavlopoulou I, Pebody R, Penttinen P, Soler-Soneira M, Wichmann O, Harrington P. Systematic review of the efficacy, effectiveness and safety of MF59® adjuvanted seasonal influenza vaccines for the prevention of laboratory-confirmed influenza in individuals ≥18 years of age. Rev Med Virol. 2023 May;33(3):e2329.,中金公司研究部
下一代流感疫苗:mRNA和通用流感疫苗持續探索中
現有流感疫苗接種保護效率僅爲40-60%,特別當疫苗毒株和流行毒株不匹配時,疫苗有效性將進一步降低。針對這一問題,更多疫苗廠商开始探索應用新技術开發更多創新疫苗,其中mRNA疫苗與通用疫苗在近年取得了一定進展。
► mRNA技術在新冠疫情展示出技術優勢,其研發周期短、規模化生產效率高且避免病毒傳代培養的適應性突變等諸多優勢理論上非常契合流感病毒疫苗的設計要求;目前Moderna旗下的成分改良版mRNA-1010已展示較爲積極的III期臨牀結果,盡管其披露數據未在臨牀層面顯示相對滅活流感疫苗的明顯優勢,但預計其有望通過快速生產制備優勢和多聯苗潛力切入市場。
► 通用流感疫苗是指可對多種流感病毒株均可產生持久保護性的通用流感疫苗,其主要難點在於抗原靶點的選擇,以及對抗原效力的評估,此類疫苗开發並不拘泥於特定技術路线,滅活/重組蛋白/mRNA/腺病毒均具備开發潛力;截至2023年12月,全球已有192款候選通用流感疫苗,其中臨牀階段有38款,III期臨牀階段有6款。
中金研究認爲mRNA流感疫苗有望率先實現商業化,建議關注mRNA-1010的後續上市申報及商業化進度,以及其他mRNA流感疫苗的开發進展;通用流感疫苗仍在尋找合適的抗原靶點,建議關注臨牀階段產品對抗原位點的概念性驗證。
mRNA流感疫苗:對乙型流感反應低是行業性難題,安全性有待優化
Moderna和輝瑞/BioNTech擁有先發優勢,老牌疫苗企業抓緊追趕。率先开發出mRNA疫苗的Moderna和輝瑞/BioNTech均將mRNA流感疫苗作爲了傳染病疫苗管线中重點布局方向之一,且均已披露了較爲積極的III期臨牀數據;此外,葛蘭素史克、CSL Seqirus和賽諾菲等一衆流感疫苗企業也先後布局了mRNA流感疫苗。
理論上,mRNA流感疫苗企業只需流感病毒的基因序列,就可以快速、大規模生產出有效性較強的流感疫苗,最大可能降低WHO預測不准的負面影響。但從商業化角度分析,不同於新冠疫苗市場的完全空白,流感疫苗市場已有穩定的產品和推廣渠道,mRNA流感疫苗需要差異化策略才有望挑战當前流感疫苗的穩定地位,其可通過技術迭代獲得更具優勢的疫苗保護效力,亦可通過與其他疫苗聯合制備成多聯疫苗,從接種便利性的角度打开市場。
mRNA-1010 (Moderna):成分改良版流感疫苗III期結果積極
mRNA-1010是由Moderna开發的四價季節性流感mRNA候選疫苗,與主流流感疫苗類似,mRNA-1010靶向甲型流感病毒株H1N1/H3N2與乙型流感病毒株Yamagata/Victoria。此前公布的P301和P302兩項臨牀中,對比標准滅活疫苗,mRNA-1010對甲流的抗體效價達到優效,但對乙流未達成非劣效性。隨後Moderna對mRNA-1010進行了配方更新,2023年9月Moderna公告該版本mRNA-1010的III期臨牀P303的中期數據結果,達到主要臨牀終點:對比流感滅活疫苗Fluarix,mRNA-1010對四種流感亞型A/H1N1、A/H3N2、B/Yamagata、B/Victoria的HAI滴度更高。在另一項頭對頭I/II期臨牀中,對比賽諾菲Fluzone高劑量疫苗,mRNA-1010對A/H1N1、A/H3N2、B/Victoria達到了更高的HAI滴度,對B/Yamagata的HAI則較爲接近;安全性方面,mRNA-1010的不良反應主要以1/2級爲主,但發生率略高於標准流感疫苗。據公司公告,Moderna已與FDA就mRNA-1010上市展开溝通,預計該產品最快於2024年獲批上市。
除mRNA-1010外,Moderna還在應用更多策略推進mRNA流感疫苗的研發,例如通過增加額外的HA抗原來提高對於甲流病毒的覆蓋度(mRNA-1011和mRNA-1012),或增加HA和NA抗原來減少病毒免疫逃逸的可能性(mRNA-1020和mRNA-1030)等,中金研究建議關注更多mRNA流感疫苗的开發進展。
圖表24:P303臨牀:mRNA-1010相較標准流感疫苗的GMT比值
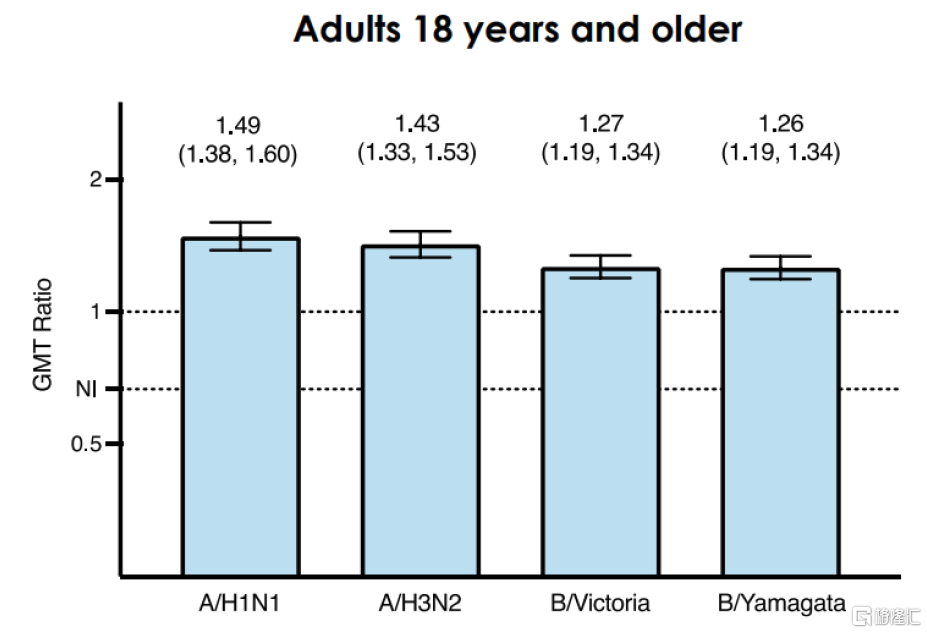
資料來源:Moderna公告,中金公司研究部
圖表25:P303臨牀:mRNA-1010相較Fluzone高劑量流感疫苗的GMT比值
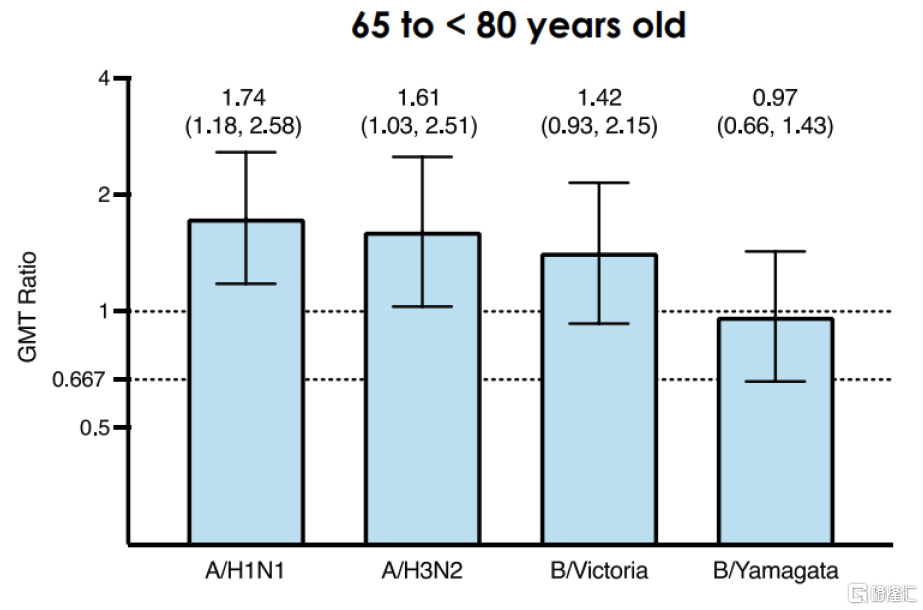
資料來源:Moderna公告,中金公司研究部
圖表26:P303臨牀:mRNA-1010安全性數據
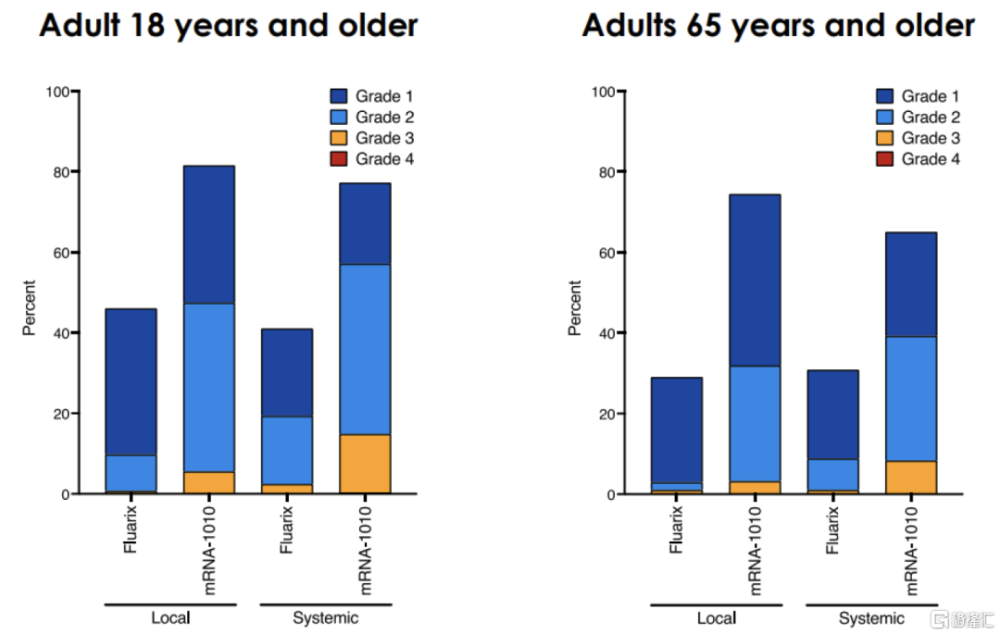
資料來源:Moderna公告,中金公司研究部
modFlu (輝瑞/BioNTech):對乙型流感病毒的低反應性仍待改善
modFlu是由輝瑞和BioNTech共同开發的第一代mRNA流感疫苗。與mRNA-1010類似,modFlu靶向甲型流感病毒株H1N1和H3N2,和乙型流感病毒株Yamagata和Victoria。2023年11月輝瑞公布了modFlu在18-64歲人群中的III期臨牀結果,達到兩項主要臨牀終點:主要臨牀終點採用流感病例的比例,modFlu不亞於標准流感疫苗,且流感季結束時進一步分析發現modFlu的有效性維持非劣於對照疫苗,但值得注意的是該流感季確證的流感病毒感染均未甲型流感;次要終點採用免疫原性分析,modFul僅針對甲型流感病毒達到終點,對乙型流感病毒未達到,兩個臨牀終點均提示modFlu對乙型流感的預防效力較差。安全性方面,modFlu在18-64歲人群的安全性特徵與標准流感疫苗類似。
據公司公告,BioNTech計劃將於近期公布modFlu在老年人群的III期臨牀數據。此外,輝瑞/BioNTech也在开發流感+新冠二合一疫苗(I/II期數據積極,公司計劃於未來數月內將开展III期臨牀)、流感+RSV二合一疫苗(I期)以及流感+新冠+RSV三合一疫苗(臨牀前)等更多新型流感疫苗。
圖表27:modFlu在18-64歲人群的III期數據

注:1. Primary and end of season analyses considered both influenza A and B cases collectively, though the vast majority of cases recorded in this trial, and during the 2022 / 2023 influenza season overall, were influenza A cases; 2. Superiority vs. the licensed influenza comparator not met at end of season analysis; Ph: Phase 資料來源:輝瑞官網,中金公司研究部
SP0273 (賽諾菲):放棄初代mRNA流感疫苗研發
流感mRNA疫苗SP0273是賽諾菲重金收購Translate Bio後的核心項目之一。2021年8月,賽諾菲斥資32億美元收購mRNA疫苗公司Translate Bio,收購後重點推進mRNA四價流感疫苗SP0273的研發。2023年6月,賽諾菲在疫苗投資者日公布了SP0273的I/II期數據(非與mRNA-101頭對頭臨牀),跨研究對比,數據與Moderna的初代mRNA-1010類似,對甲流的保護效力良好,但對乙流表現不佳;安全性方面,SP0273劣於主流滅活流感疫苗,但優於mRNA-1010。由於SP0273的臨牀數據不佳,賽諾菲已停止初代mRNA流感疫苗开發,並積極通過AI優化抗原設計和毒株選擇,以強化疫苗對乙流的免疫響應。
圖表28:SP0273的有效性數據
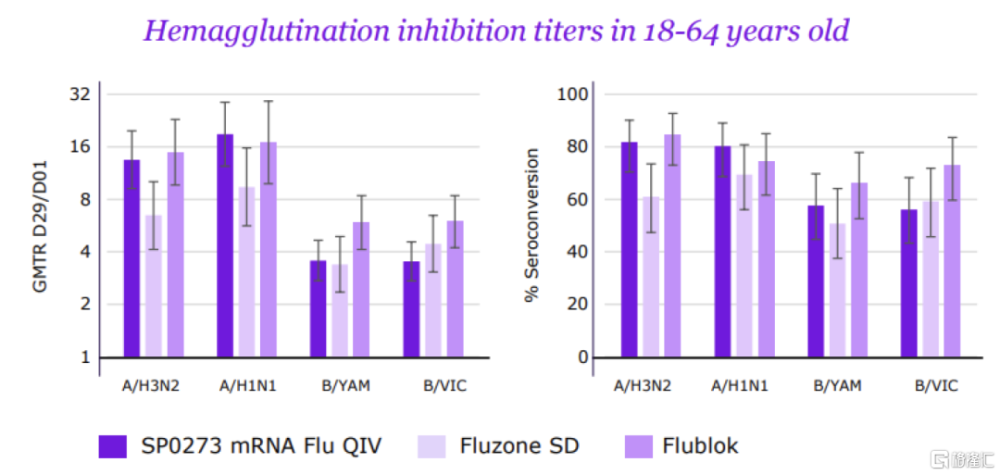
資料來源:賽諾菲官網,中金公司研究部
圖表29:SP0273的安全性數據
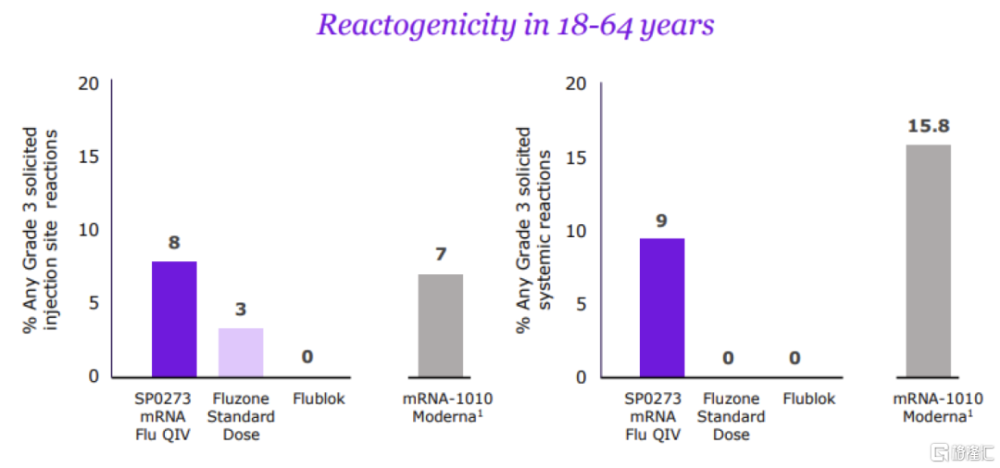
資料來源:賽諾菲官網,中金公司研究部
通用流感疫苗:流感疫苗理想形態,抗原篩選是主要難題
理想的通用流感疫苗可提供針對所有流感毒株的長期免疫。傳統流感疫苗的抗原主要採用血凝素(HA)的頭部區域,該部分最容易成爲免疫系統的攻擊目標,但該區域結構不穩定,相關基因容易發生突變,造成流感疫苗對新的病毒亞型幾乎沒有保護作用。基於新型疫苗平台的通用流感候選疫苗大多針對保守抗原,如M2e、HA stem、NP和M1,旨在誘導強交叉保護抗體反應和強交叉反應T細胞反應,以實現對所有流感病毒亞型的預防保護效果。根據蓋茨通用流感疫苗基金會,截至2023年12月,全球已有192款、包括6種疫苗开發平台的候選通用流感疫苗在研,其中臨牀階段有38款,III期臨牀階段有6款。
圖表30:全球通用流感疫苗進度(II/III期,截至2023年底)
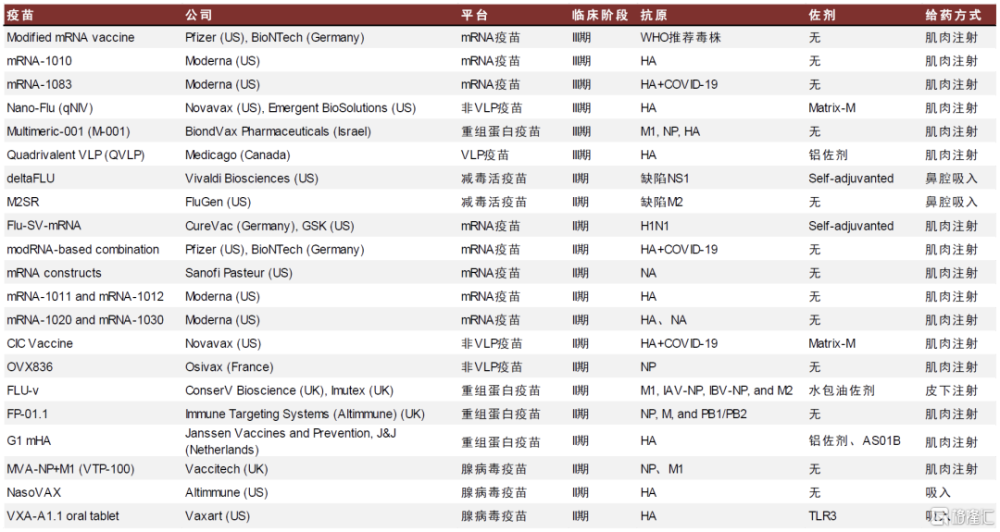
資料來源:蓋茨通用流感疫苗基金會,中金公司研究部
較容易結合的血凝素(HA)的保守區域(莖部)是目前通用流感疫苗的主要方向。與高變異性的 HA 頭部相比,HA 莖部以及新的靶點NA、M2e和NP,具有更高的保守性,更有通用疫苗研究的潛力。理論上各類疫苗平台均具備开發出通用流感疫苗的潛力,但目前尚未有較爲積極的數據讀出,中金研究建議關注臨牀階段產品對抗原位點的概念性驗證。
國內市場展望:滅活流感疫苗仍是主要路线,新型流感疫苗處於對標追趕階段
中國流感疫苗技術路线趨同,存在迭代空間
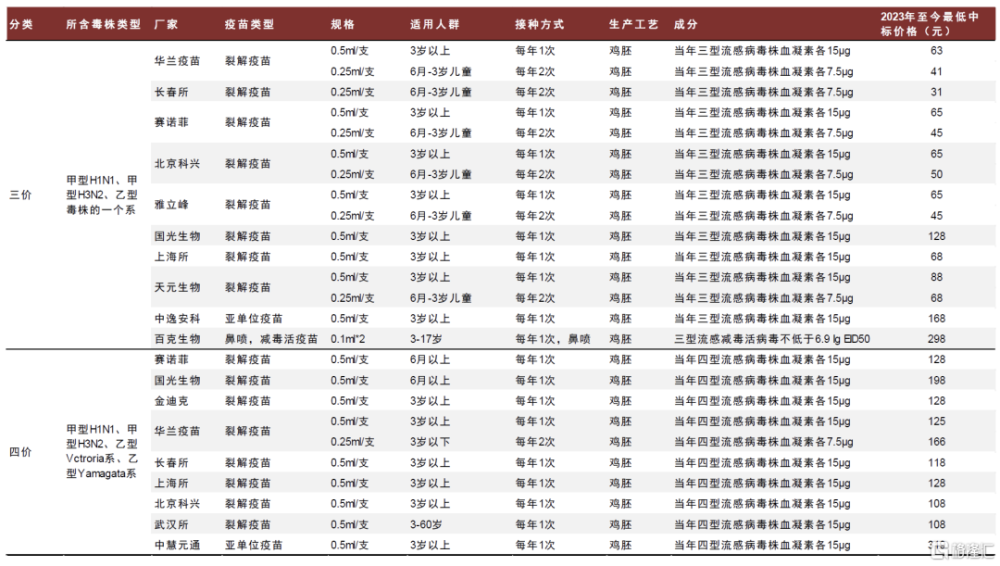
除百克生物外,國內上市流感疫苗均採用傳統滅活裂解技術。1996年,賽諾菲引入國內第一支流感疫苗;同一時期,國家優化疫苗行業准入的行政管制,加速民營疫苗企業的成立和發展。面對海外發展成熟的滅活流感疫苗技術路线,國內廠商直接採用Follow策略开發國產流感疫苗,明顯加速了國產流感疫苗的上市。經過20多年的發展,國內大部分疫苗廠商已具備了滅活流感疫苗技術,大部分疫苗廠商也將流感疫苗作爲管线布局之一,導致了國內流感疫苗行業陷入同質化競爭。截至2023年12月,中國已經批准上市的流感疫苗以滅活流感疫苗爲主,其中三價苗15款,四價苗10款。
► 三價流感疫苗:三價苗由於上市時間較早,國內擁有產能和生產文號的疫苗企業衆多,其中代表性企業包括科興生物、長春所、華蘭疫苗和賽諾菲等。2018年疫苗行業安全性事件導致三價流感疫苗供給明顯下滑,除此外之外行業整體供應量保持穩定提升。但由於四價苗自2018年快速放量,三價苗的市場率市佔率明顯下滑,2018年、2020年和2022年其批籤發量市場率分別爲57%、46%和32%。近些年行業細分格局有所調整,華蘭疫苗、長春所等企業將業務重心轉移至四價流感疫苗,導致其市場份額下滑,而科興、賽諾菲等企業市場份額不斷提升。
► 四價流感疫苗:四價苗上市時間較晚,2018年華蘭疫苗推出國內首個產品,但隨後行業以每年增加1-2款產品的速度持續擴容,目前代表性企業包括華蘭疫苗、金迪克等。2018年起華蘭疫苗旗下四價苗拉動國內流感疫苗市場擴容,據中檢院批籤發數據,四價苗的市場佔比快速提高,2023年四價苗的市佔率已爬升至75%。近些年隨着更多企業湧入四價流感疫苗市場,頭部企業的市佔率出現逐步下滑的趨勢。
圖表31:國內流感疫苗批籤發次數(2016-2023)
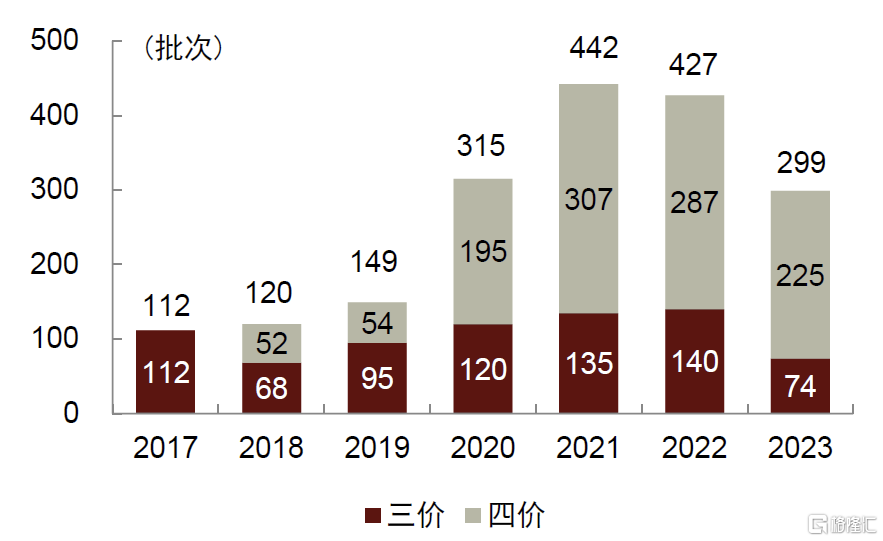
資料來源:中檢院,中金公司研究部
圖表32:中國流感疫苗批籤發數量(2017-2021)
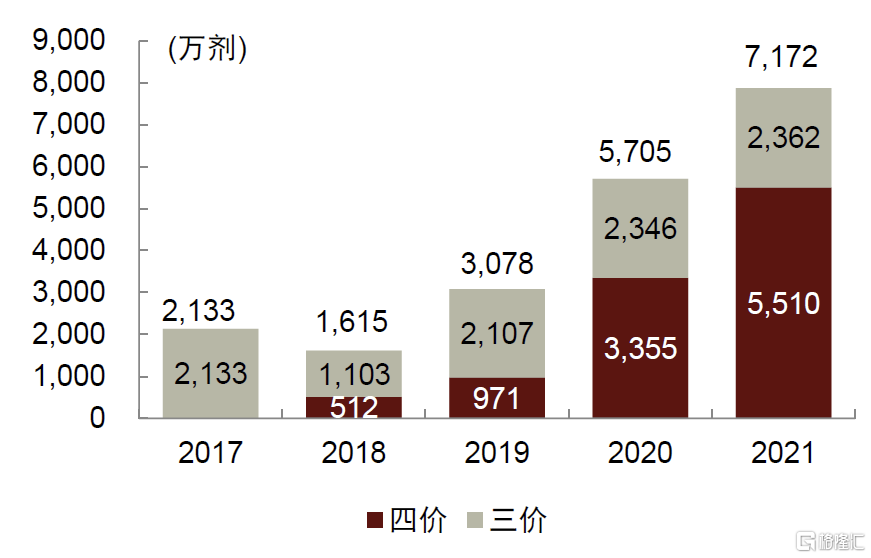
資料來源:各公司公告,中金公司研究部
圖表33:流感疫苗市佔率(按批籤發量計算)
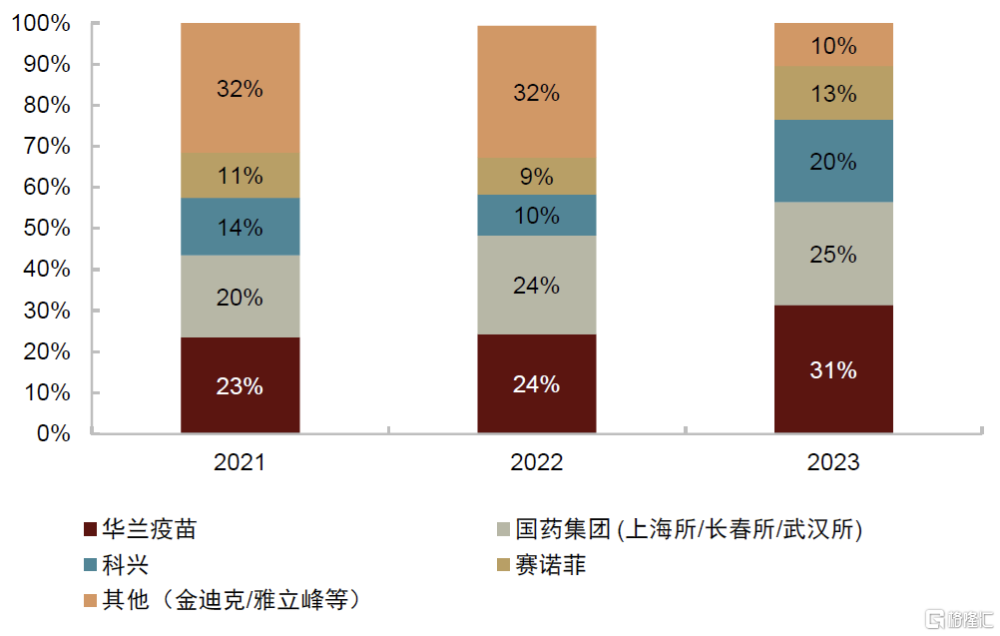
資料來源:IQVIA,中檢院,中金公司研究部
圖表34:國內上市流感疫苗競爭格局(截至2023年12月)
資料來源:藥智網,中國流感疫苗預防接種技術指南(2022-2023),中金公司研究部
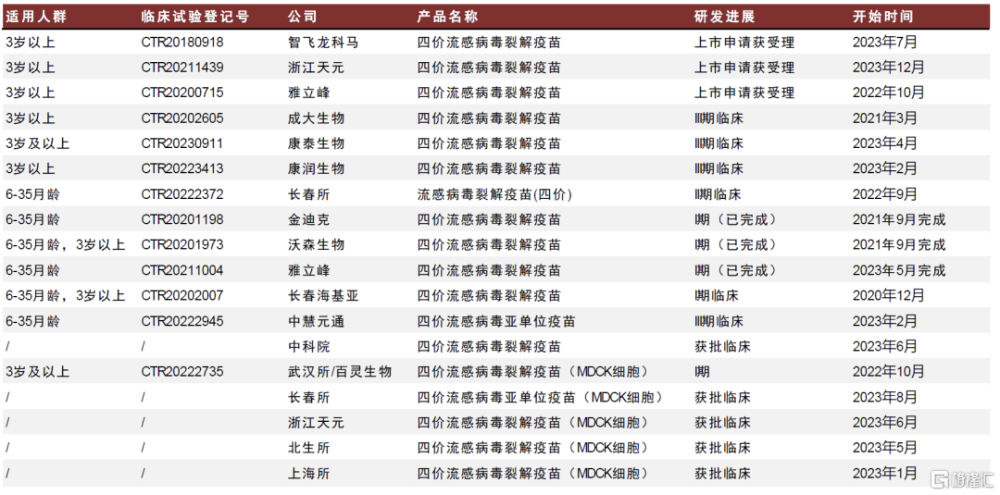
多款流感疫苗處於在研階段。根據CDE和Insight數據庫,國內在研四價流感疫苗以滅活路线爲主,其中進度居前的智飛龍科馬(智飛生物全資子公司)、雅立峰生物(復星醫藥全資子公司)、浙江天元(步長制藥子公司)生產注冊已獲受理;康潤生物、康泰生物、成大生物均處於III期臨牀階段。創新路线方面,公司已有5家企業的四價流感疫苗(MDCK細胞)進入臨牀階段。
圖表35:國內在研流感疫苗競爭格局(截至2023年12月)
資料來源:Insight,CDE,中金公司研究部
國內流感疫苗接種率擁有較大提升空間
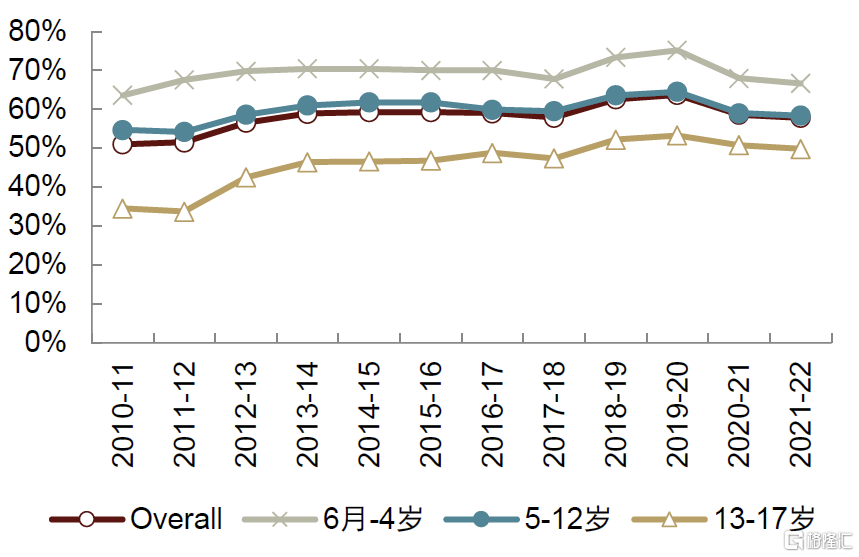
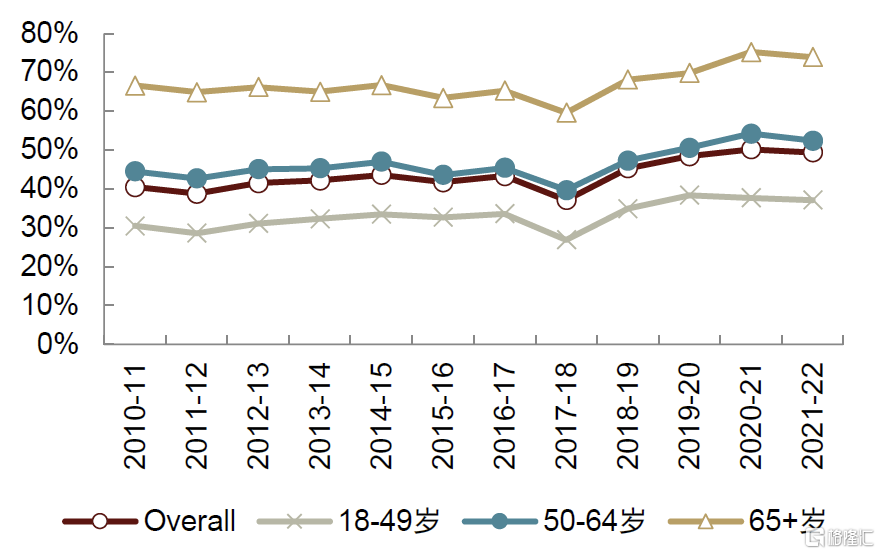
得益於支付體系完善、居民接種意識高以及接種場所靈活,美國流感接種率長期較高。據美國CDC,2021-2022年美國6月齡及以上人口接種率爲51.4%,其中兒童/青少年和老年人接種率均超過65%。ACIP自2010年起大力推薦接種流感疫苗,此外完善支付能力、群衆接種意識和接種場所靈活構成美國流感疫苗接種率較高的主要原因:1)支付能力上,美國商保、Medicare等保險全面覆蓋流感疫苗,超3/4的民衆可免費接種;2)接種意識上,經過多年教育,美國民衆對流感疫苗接種的必要性和重要性認知較高;3)接種便利性上,美國可在各大藥房、醫院診所、醫務室甚至流動疫苗車接種流感疫苗,且可自由選擇工作日/上學日前往接種。
圖表36:美國6個月至17歲兒童流感疫苗接種率
資料來源:美國疾病預防控制中心,中金公司研究部
圖表37:美國18歲及以上成年人流感疫苗接種率
資料來源:美國疾病預防控制中心,中金公司研究部
受限於自費支付政策、居民接種意識不足以及疫苗可及性不佳,國內流感疫苗接種率有明顯提升空間。據2022年全國疫苗和健康大會和疾控中心數據,2020-21年、2021-22年和2022-23年流感季,國內全人群流感疫苗接種分別爲3.34%、2.47%和3.84%。國內流感疫苗接種率較低受多方面影響:1)大衆對流感的危害和流感疫苗的預防作用認識不足;2)流感疫苗自費政策限制了部分人群接種積極性;3)流感疫苗可及性不足,例如部分接種點供不應求。預計隨着各地陸續推出流感疫苗免費接種方案,以及各企業加大流感疫苗教育推廣進度,國內流感疫苗接種率有望逐步提升。
圖表38:免費接種和醫保報銷政策下人群流感疫苗接種情況(2020-2021和2021-2022年度流感流行季)
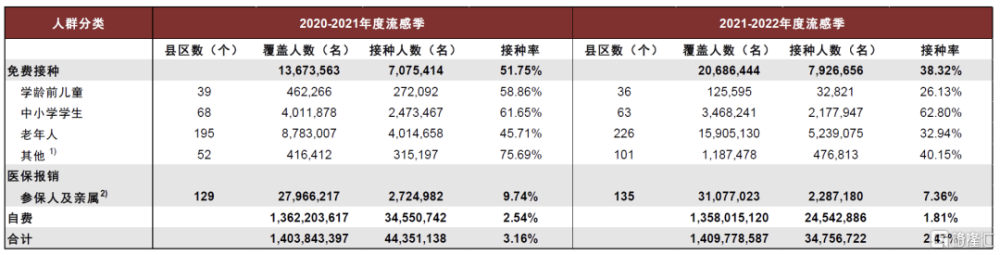
注:1)包括醫務人員、重大活動保障人員、公安幹警、教師、養老幼托機構工作人員等;2)包括學齡前兒童、中小學學生、老年人、監管人員、醫務人員、機關單位工作人員等參保人及其親屬,未對醫保報銷政策的覆蓋人群未進行分類調查;3)2個年度流感流行季分別爲2020年9月-2021年1月;2021年10月-2022年3月。 資料來源:趙宏婷, 彭質斌, 倪兆林, 等. 2020—2021和2021—2022年度流感流行季我國流感疫苗接種政策和接種情況調查 [J] . 中華預防醫學雜志, 2022, 56(11) : 1560-1564. DOI: 10.3760/cma.j.cn112150-20220810-00802.,中金公司研究部
近年新冠流感疫情中斷國內流感疫苗放量提升節奏,疫後放量正逐步恢復。據金迪克公告,2018年四價流感疫苗上市同時國家鼓勵重點人群接種流感疫苗,帶動國內疫苗接種率快速提升,2020-21年流感季全國流感疫苗接種量接近5,000萬支,對應接種率爲3.34%;2021年初疾控中心預測2021-22流感季全國流感疫苗的潛在需求量約爲8,907萬支(8,352-9,473萬支),行業內當年生產批籤發超7千萬支,但由於疾控資源主要傾斜給新冠疫苗接種,實際流感疫苗接種量低於上一年度,對應接種率僅爲2.47%。2022-23年流感季生產批籤發繼續維持高位,2022年冬季國內新冠爆發導致流感疫苗接種繼續下滑,但2023年初國內甲流流行拉動接種明顯恢復,據疾控中心數據,2022-23年流感季接種率恢復至3.84%。2023-24年流感季國內各地出現不同程度的流感高水平活動,預計或進一步利好流感疫苗的終端放量。
中性假設下,預計國內流感疫苗市場規模有望達到110億元,對應全人口接種率約9%。中國疾病預防控制中心重點推進老年人及兒童等易感人群接種流感疫苗,預計未來仍將延續兒童和老年人流感疫苗市場佔據主要份額的趨勢。中性假設下,預計各年齡組流感疫苗接種率相較2020-21年流感季增加一倍,疫苗平均價格下滑到80-90元/劑,則國內流感疫苗市場規模爲110億元。值得注意的是,該假設暫未考慮潛在新型流感疫苗的貢獻,參考海外新型流感疫苗定價往往高於標准流感疫苗,中金研究認爲未來新型流感疫苗有望進一步提高國內流感疫苗的市場規模的天花板。
圖表39:中國流感疫苗市場規模預測
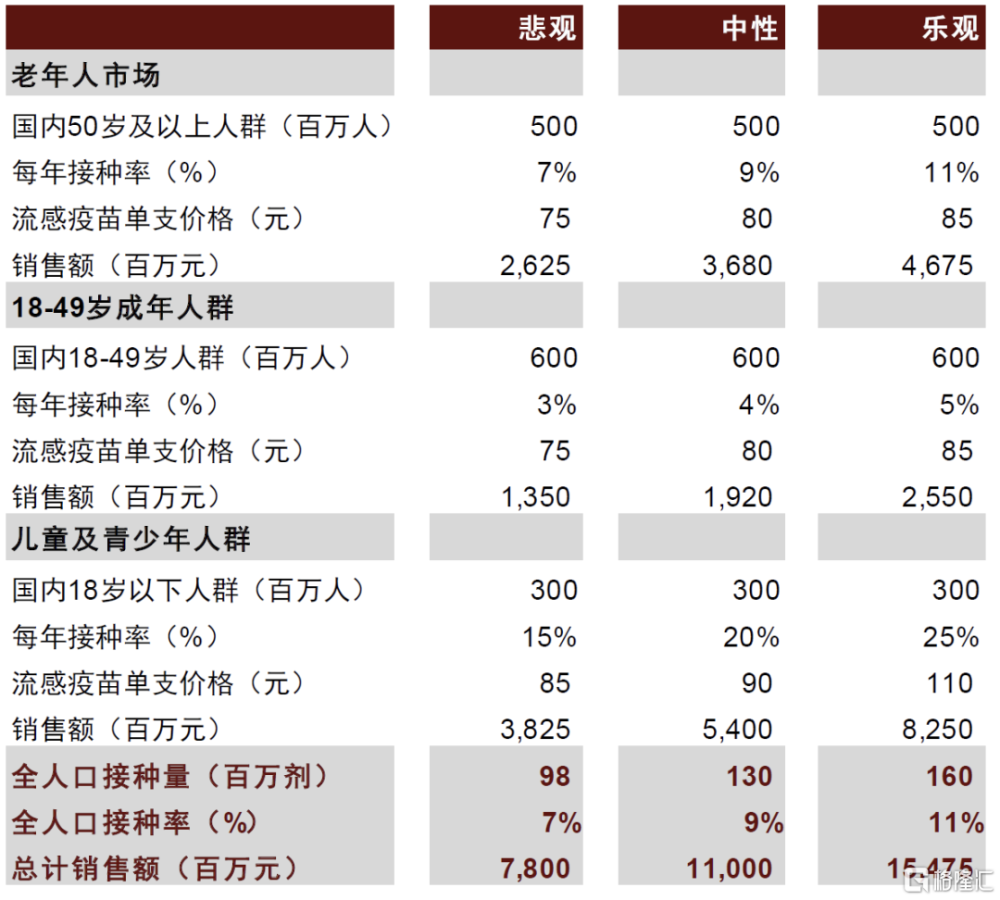
注:人口數據根據21年人口普查測算 資料來源:國家統計局,中金公司研究部
風險
► 疫苗安全性問題:國內各監管部門對疫苗產品質量強監管,如果公司產品出現安全性問題,可能導致產品停產或者退市。
► 疫苗研發進度不及預期:疫苗研發涉及I/II/III期臨牀,對疫苗的安全性、有效性、GMP生產提出較高要求,若某一環節受阻,可能導致疫苗研發進度推遲。
注:本文摘自中金研究2024年1月17日已經發布的《疫苗行業系列報告:創新流感疫苗重塑海外競爭格局》,分析師: 鄒 朋 S0080513090001 ;鄭航慈 S0080522080007; 楊一正 S0080523100002
標題:中金:創新流感疫苗重塑海外競爭格局
地址:https://www.iknowplus.com/post/73273.html







