高端流感疫苗遭疑在台試驗不全 食藥署:未限臨牀試驗執行地點
(中央社記者沈佩瑤台北18日電)藍委質疑高端流感疫苗在台灣未經完整臨牀試驗,食藥署今天表示,未限定臨牀試驗執行地點,若經評估無族群差異得引用國外資料,綜合數據支持高端疫苗具療效及安全性。
每年10月進入秋冬流感季,今年公費流感疫苗10月2日分階段開打,這次除了賽諾菲、國光、東洋廠牌以外,高端公司引進韓國疫苗大廠GC Biopharma四價流感疫苗,首次加入公費流感疫苗行列。
中國國民黨立委王鴻薇昨天在臉書質疑,高端在台灣的臨牀試驗是針對20到50歲,其他年齡層則是在韓國所做,衛生福利部用商業機密來拒絕公開韓國GC臨牀數據,如何讓國人相信。
有關台灣針對四價流感疫苗的查驗登記標準,衛福部食品藥物管理署副署長陳惠芳今天在例行記者會中說明,台灣與國際醫藥法規協和會(ICH)接軌,依據藥品查驗登記審查準則規定,應檢附「化學製造管制」、「非臨牀試驗」及「臨牀試驗」等資料供審核。
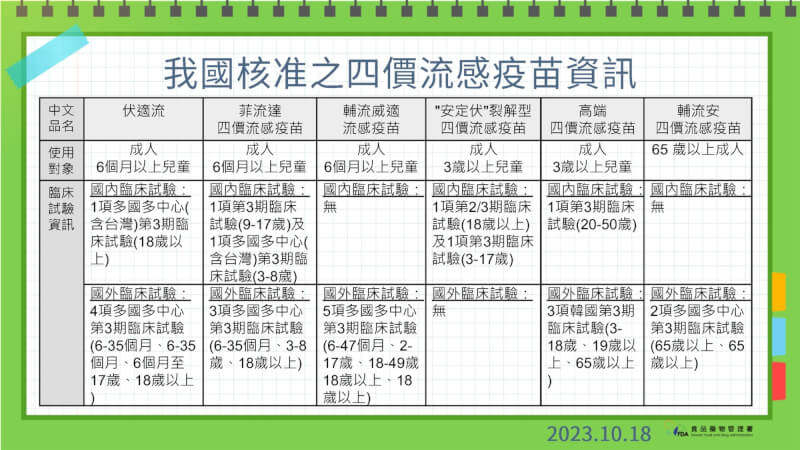
其中,臨牀試驗並未限定試驗執行的地點,而是視廠商所附整體臨牀試驗數據結果,審查其療效及安全性。陳惠芳指出,台灣是依ICH E5所訂的銜接性試驗基準,審視該藥品是否具有族群差異,若經評估無族群差異者,得引用國外臨牀試驗數據資料,未要求必須於國內執行臨牀試驗或執行全年齡層的臨牀試驗,以減少重複進行臨牀試驗。
她進一步解釋,高端臨牀試驗資料已檢附韓國執行的第1、2期及第3期臨牀試驗,受試者年齡為3至18歲、19歲以上及65歲以上的資料,同時在台灣執行第3期臨牀試驗,受試者年齡20至50歲,綜合韓國及台灣臨牀試驗結果,可支持其療效及安全性,銜接性試驗評估亦顯示無族群差異的疑慮。
陳惠芳並秀出目前台灣已核准的6種四價流感疫苗資訊列表說明,皆依據相同標準進行審查,因評估無族群差異,並非都在國內執行臨牀試驗或全年齡層臨牀試驗。
針對資料保密規定一事,陳惠芳表示,依據藥事法第40條之1及營業祕密法第2條規定,藥品查驗登記時所檢附原始數據屬營業祕密的資料,食藥署應保密;另外藥品查驗登記所檢附的臨牀試驗相關資訊,會摘錄重點刊載於核准仿單中。(編輯:陳政偉)1121018
標題:高端流感疫苗遭疑在台試驗不全 食藥署:未限臨牀試驗執行地點
地址:https://www.iknowplus.com/post/43154.html

![12強台灣轟垮澳洲 睽違21年晉成棒世界賽4強[影]](https://imgcdn.cna.com.tw/www/WebPhotos/800/20241117/1200x918_wmky_650417339763_202411170188000000.jpg)